Cleosensa - õhukese polümeerikattega tablett (0 +0/3mg +0,02mg) - Ravimi omaduste kokkuvõte
Artikli sisukord
RAVIMI OMADUSTE KOKKUVÕTE
1.RAVIMPREPARAADI NIMETUS
Cleosensa, 0,02 mg/3 mg õhukese polümeerikattega tabletid
2.KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS
24 roosat õhukese polümeerikattega tabletti (toimeaineid sisaldavad tabletid)
Iga õhukese polümeerikattega tablett sisaldab 0,02 mg etünüülöstradiooli ja 3 mg drospirenooni. INN. Ethinylestradiolum, drospirenonum
Teadaolevat toimet omav abiaine:
Iga õhukese polümeerikattega tablett sisaldab 44 mg laktoosmonohüdraati.
4 valget õhukese polümeerikattega platseebotabletti (toimeaineta) Tablett ei sisalda toimeaineid.
Teadaolevat toimet omav abiaine:
Iga õhukese polümeerikattega tablett sisaldab 89,5 mg veevaba laktoosi.
Abiainete täielik loetelu vt lõik 6.1.
3.RAVIMVORM
Õhukese polümeerikattega tablett.
Toimeaineid sisaldavad tabletid: Roosad, siledad, 5,7 x 3,5 mm, ümmargused, õhukese polümeerikattega tabletid.
Platseebotabletid: Valged, siledad, 5,7 x 3,5 mm, ümmargused, õhukese polümeerikattega tabletid.
4.KLIINILISED ANDMED
4.1Näidustused
Raseduse vältimine.
Cleosensa väljakirjutamisel tuleb võtta arvesse konkreetsel naisel käesoleval hetkel esinevaid riskifaktoreid, eriti venoosse trombemboolia (VTE) riskifaktoreid, ja seda, milline on VTE risk koos Cleosensa'ga võrreldes teiste kombineeritud hormonaalsete kontratseptiividega (vt lõigud 4.3 ja 4.4).
4.2Annustamine ja manustamisviis
Annustamine
Tablette tuleb võtta iga päev
Kuidas alustada Cleosensa võtmist
•Hormonaalseid rasestumisvastaseid vahendeid pole eelnevalt (möödunud kuul) kasutatud

Tablettide võtmist tuleb alustada naise normaalse menstruaaltsükli 1. päeval (st menstruaalverejooksu esimesel päeval).
•Üleminek kombineeritud hormonaalselt rasestumisvastaselt vahendilt (kombineeritud
suukaudne kontratseptiiv (KSK), tuperõngas või nahaplaaster)
Eelistatult peaks naine Cleosensa’ga alustama varem kasutatud KSK viimase aktiivse tableti (viimase toimeainet sisaldava tableti) võtmisele järgneval päeval, kuid hiljemalt eelneva KSK tavapärasele tabletivabale perioodile või platseebotablettide perioodile järgneval päeval. Tuperõngalt või nahaplaastrilt üleminekul tuleb Cleosensa kasutamist eelistatavalt alustada selle eemaldamise päeval, kuid hiljemalt vastava vahendi ettenähtud järgmise paigaldamise ajal.
•Üleminek ainult progestageeni sisaldavalt meetodilt (ainult progestageeni sisaldav tablett, süst,
•Esimese trimestri abordi järgselt
Naine võib alustada kohe. Sellisel juhul ei ole täiendavate rasestumisvastaste meetmete rakendamine vajalik.
•Sünnituse või teise trimestri abordi järgselt
Soovitatav on alustada 21...28. päeval pärast sünnitust või teise trimestri aborti. Hilisema alguse korral tuleb naisele soovitada barjäärimeetodi täiendavat kasutamist esimese 7 päeva jooksul. Kuid kui vahekord on juba toimunud, tuleb enne KSK kasutamist välistada rasedus või oodata ära esimene menstruatsioon.
Imetavate naiste kohta vt lõik 4.6.
Mida teha kui tablett jäi võtmata
Viimases
Kui kasutaja on tableti võtmisega hilinenud vähem kui 24 tundi, ei ole rasestumisvastane toime nõrgenenud. Naine peab võtmata jäänud tableti võtma niipea, kui see talle meenub. Edasi tuleb tablette võtta tavapärastel aegadel.
Kui kasutaja on tableti võtmisega hilinenud rohkem kui 24 tundi, võib rasestumisvastane toime olla nõrgenenud. Unustatud tablettide korral on vaja järgida kahte põhireeglit:
1.Soovitatav hormoonivabade tablettide periood on 4 päeva, tablettide võtmises ei tohi kunagi tekkida pikemat pausi kui 7 päeva;
2.Selleks, et saavutada
Sellest lähtuvalt saab igapäevases praktikas anda järgnevat nõu:
-Päevad 1...7
Kasutaja peab võtma viimase võtmata jäänud tableti niipea, kui see talle meenub, isegi kui see tähendab, et samal ajal tuleb võtta kaks tabletti. Seejärel tuleb tablettide võtmist jätkata tavapärasel ajal. Lisaks tuleb järgneva 7 päeva jooksul kasutada ka barjäärimeetodit, nt kondoomi. Kui kasutaja oli eelneva 7 päeva jooksul vahekorras, tuleb arvestada võimaliku rasedusega. Mida rohkem tablette on võtmata jäänud ning mida lähemale jääb see tabletivabale perioodile, seda suurem on rasestumise risk.

-Päevad 8...14
Kasutaja peab võtma viimase võtmata jäänud tableti niipea, kui see talle meenub, isegi kui see tähendab, et samal ajal tuleb võtta kaks tabletti. Seejärel tuleb tablettide võtmist jätkata tavapärasel ajal. Eeldusel, et esimesele ununenud tabletile eelnenud 7 päeval on tablette manustatud õigesti, pole täiendavate rasestumisvastaste abinõude rakendamine vajalik. Kui aga võtmata on jäänud enam kui 1 tablett, tuleb järgneva 7 päeva jooksul rakendada täiendavaid abinõusid raseduse vältimiseks.
-Päevad 15...24
Läheneva platseebotablettide perioodi tõttu on rasestumisvastase toime nõrgenemise risk suur. Rasestumisvastase toime nõrgenemist võib aga vältida, kui reguleerida tablettide võtmise graafikut. Kui kasutada ühte kahest järgnevast võimalusest, ei teki vajadust rasestumisvastaste lisaabinõude järele, eeldades, et eelnevad 7 päeva enne tableti vahelejätmist on korralikult tablette võetud. Kui see aga nii ei ole, tuleb kasutada kahest järgnevast võimalusest esimest ja lisaks ka täiendavaid kaitsevahendeid järgmise 7 päeva jooksul.
1.Kasutaja peab võtma viimase võtmata jäänud tableti niipea, kui see talle meenub, isegi kui see tähendab, et samal ajal tuleb võtta kaks tabletti. Edasi võetakse tablette tavalisel ajal, kuni toimeainega tabletid on ära võetud. Viimase rea neli platseebotabletti tuleb ära visata. Kohe tuleb alustada järgmise blisterpakendiga. Tõenäoliselt ei esine kasutajal menstruatsioonitaolist vereeritust enne, kui teise pakendi toimeainet sisaldavad tabletid on lõpuni kasutatud, kuid tal võib tablettide võtmise aja esineda määrimist või tsüklivälist veritsust.
2.Naisele võib ka soovitada lõpetada tablettide võtmine käigusolevast blisterpakendist. Seejärel peab ta võtma kuni 4 päeva jooksul platseebotablette viimasest reast, arvestades sisse ka päevad, mil tabletid jäid võtmata ning seejärel jätkama järgmise blisterpakendiga.
Kui naisel jäi tablett võtmata ja pärast seda ei esinenud esimesel tavapärasel tabletivabal perioodil menstruatsioonilaadset vereeritust, tuleb arvestada raseduse võimalusega.
Mida teha seedetrakti häirete korral
Raskete seedetrakti häirete (nt oksendamine või kõhulahtisus) korral ei pruugi imendumine olla täielik ja rakendada tuleb täiendavaid rasestumisvastaseid meetmeid. Kui oksendamine esineb 3...4 tunni jooksul pärast tableti manustamist, tuleb esimesel võimalusel võtta uus
Kuidas menstruatsioonilaadset vereeritust edasi lükata
Menstruatsiooni edasilükkamiseks peab kasutaja alustama uut Cleosensa blisterpakendit ilma kasutatavast pakendist platseebotablettide perioodita. Pikendamine on võimalik soovitud arvu päevade võrra kuni toimeainet sisaldavate tablettide teise pakendi lõppemiseni. Pikendamise vältel on võimalik läbimurdeveritsus või määrimine. Cleosensa regulaarset võtmist jätkatakse pärast platseebotablettide perioodi.
Kui naine soovib menstruatsiooni algust nihutada mõnele teisele, senikasutatavast skeemist erinevale nädalapäevale, tuleb tal platseebotableti perioodi lühendada vastavalt nii mitu päeva kui ta soovib. Mida lühemaks jääb intervall, seda väiksem on menstruatsioonilaadse vereerituse esinemise võimalus ning seda suurem on läbimurdeveritsuse ja määriva vereerituse võimalus teise pakendi kasutamise ajal (sarnaselt tsükli pikendamisele).
Manustamisviis
Suukaudne.
4.3Vastunäidustused
Kombineeritud hormonaalseid kontratseptiive (KHK) ei tohi kasutada järgmiste seisundite esinemisel. Kui mõni neist seisunditest ilmneb esmakordselt KHK kasutamise ajal, tuleb preparaadi kasutamine viivitamatult lõpetada.
-Venoosne trombemboolia (VTE) või selle tekkerisk.
O Venoosne trombemboolia - käesolev
O Teadaolev pärilik või omandatud eelsoodumus venoosse trombemboolia tekkeks, nt
aktiveeritud
OSuurem kirurgiline protseduur koos pikaajalise liikumatusega (vt lõik 4.4).
OMitme riskifaktori esinemisest tingitud venoosse trombemboolia kõrge risk (vt lõik 4.4).
-Arteriaalne trombemboolia (ATE) või selle tekkerisk.
OArteriaalne trombemboolia - käesolev või anamneesis (nt müokardiinfarkt) või selle eelne seisund (nt stenokardia).
OTserebrovaskulaarne haigus – insult praegu või anamneesis või selle eelne seisund (nt mööduv isheemiline atakk).
OTeadaolev pärilik või omandatud eelsoodumus arteriaalse trombemboolia tekkeks, nt hüperhomotsüsteineemia ja fosfolipiidivastased antikehad (kardiolipiinivastased antikehad, luupusantikoagulant).
OVarem esinenud koldeliste neuroloogiliste sümptomitega migreen.
OKõrge risk arteriaalse trombemboolia tekkeks mitme riskifaktori esinemise tõttu (vt lõik 4.4) või kui esineb üks tõsine riskifaktor näiteks:
-vaskulaarsete sümptomitega suhkurtõbi
-raske hüpertensioon
-raske düslipoproteineemia
-Raske maksahaigus käesolevalt või anamneesis, kuni maksafunktsiooni näitajad pole normaliseerunud.
-Raske neerupuudulikkus või äge neerukahjustus.
-Maksakasvaja (hea- või pahaloomuline) käesolevalt või anamneesis.
-Teadaolev või kahtlustatav suguhormoonidest sõltuv (näiteks suguelundite või rinnanäärmete) pahaloomuline kasvaja.
-Ebaselge etioloogiaga vaginaalne verejooks.
-Ülitundlikkus toimeainete või lõigus 6.1 loetletud mis tahes abiainete suhtes.
-Cleosensa samaaegne kasutamine ombitasviiri/ paritapreviiri/ ritonaviiri ja dasabuviiri sisaldavate ravimitega on vastunäidustatud (vt lõigud 4.4 ja 4.5).
4.4Erihoiatused ja ettevaatusabinõud kasutamisel
Hoiatused
Kui esineb ükskõik milline allpool nimetatud seisunditest või riskifaktoritest, tuleb Cleosensa sobivust arutada koos naisega.
Naisele tuleb öelda, et nimetatud seisundite või riskifaktorite ägenemisel või esmakordsel ilmnemisel tuleb pöörduda oma arsti poole, et teha kindlaks, kas Cleosensa kasutamine tuleb katkestada.
Arvesse tuleb võtta ka antikoagulantravi võimalust. Antikogulantravi (kumariinid) teratogeensuse tõttu tuleb alustada alternatiivse kontratseptsiooniga.
Venoosse trombemboolia (VTE) risk
Mis tahes kombineeritud hormonaalse kontratseptiivi (KHK) kasutamine suurendab venoosse trombemboolia (VTE) tekkeriski võrreldes mittekasutamisega. Levonorgestreeli, norgestimaati või noretisterooni sisaldavad ravimid on madalaima VTE tekkeriskiga. Teistel ravimitel, nt Cleosensa, võib VTE risk olla kuni kaks korda suurem. Otsus mis tahes ravimi kasutamise kohta, mis ei ole madalaima VTE tekkeriskiga, tuleb teha alles pärast naisega nõu pidamist, veendumaks, et ta mõistab Cleosensa kasutamisega seotud VTE tekkeriski; seda, kuidas tema olemasolevad riskifaktorid seda riski mõjutavad ja et tema VTE tekkerisk on kõige kõrgem
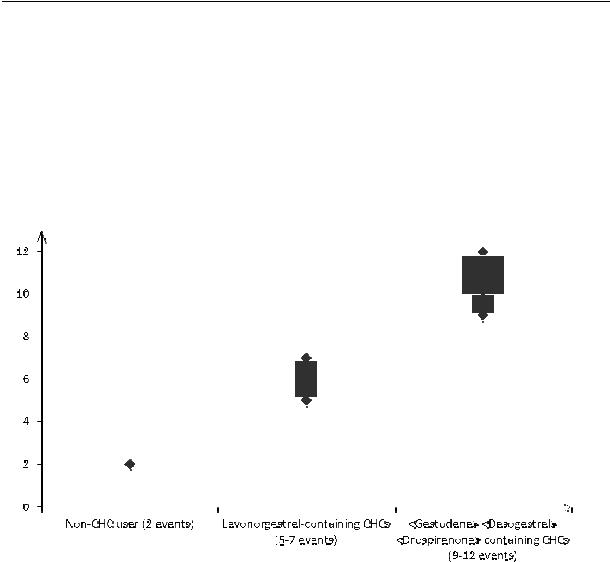
esimesel kasutamisaastal. On olemas ka mõned tõendid selle kohta, et VTE risk suureneb ka
Naistel, kes ei kasuta
Hinnanguliselt1 tekib VTE ühe aasta jooksul 9…12 naisel
1 Need juhud määratleti epidemioloogilise uuringu kõikide andmete alusel, kasutades erinevate ravimite suhtelisi riske võrrelduna levonorgestreeli sisaldavate
2 Levonorgestreeli sisaldavate
VTE juhtude arv aastas on mõlemal juhul väiksem, kui VTE eeldatav esinemissagedus raseduse ajal või sünnitusjärgsel perioodil.
VTE võib 1…2% juhtudest lõppeda surmaga.
VTE juhtude arv 10000 naise kohta ühes aastas
VTE
 juhtude arv
juhtude arv
|
Levonorgestreeli sisaldavad |
|
Drospirenooni sisaldavad |
|
|
|
|
||
|
|
(5…7 juhtu) |
|
(9…12 juhtu) |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Väga harva on
VTE riskifaktorid
KHK kasutajatel võib venoosse trombemboolia tüsistuste risk märkimisväärselt suureneda naistel, kellel esinevad täiendavad riskifaktorid, eriti, kui neid on mitu (vt tabel).
Cleosensa on vastunäidustatud, kui naisel on mitu riskifaktorit, mille tõttu on risk venoosse tromboosi tekkeks kõrge (vt lõik 4.3). Kui naisel on riskifaktoreid rohkem kui üks, võib riski suurenemine olla suurem kui üksikute riskifaktorite summa. Sellisel juhul tuleb arvestada naise VTE koguriskiga. Kui ravimi kasu/riski suhet peetakse negatiivseks, ei tohi
Tabel: VTE riskifaktorid
Riskifaktor |
Märkus |
Rasvumine (kehamassiindeks üle 30 |
KMI tõusuga suureneb risk märkimisväärselt. |
kg/m²) |
Eriti oluline on seda arvestada juhul, kui esineb ka teisi |
|
riskifaktoreid. |
Pikaajaline liikumatus, suurem |
Nendel juhtudel on soovitatav plaastri/pilli/rõnga kasutamine |
kirurgiline protseduur, mis tahes |
katkestada (plaanilise kirurgilise protseduuri korral vähemalt |
jalgade või vaagnapiirkonna |
neli nädalat varem) ja mitte taasalustada enne, kui täielikust |
operatsioon, neurokirurgia või |
liikumisvõime taastumisest on möödunud kaks nädalat. |
ulatuslik trauma |
Soovimatu raseduse vältimiseks tuleb kasutada muud |
|
rasestumisvastast vahendit. |
|
Kui Cleosensa kasutamist ei ole eelnevalt katkestatud, tuleb |
|
kaaluda tromboosivastast ravi. |
Märkus: ajutine liikumatus, sh |
|
lennureis kestusega üle 4 tunni, võib |
|
samuti olla VTE riskifaktoriks, eriti |
|
naistel, kellel esineb ka teisi |
|
riskifaktoreid |
|
Esinemine perekonnas (venoosne |
Päriliku eelsoodumuse kahtlusel tuleb enne mis tahes KHK |
trombemboolia õdedel/vendadel või |
määramise otsust saata naine eriarsti konsultatsioonile. |
vanematel, eriti just suhteliselt |
|
noores eas, nt enne 50. eluaastat) |
|
Teised |
Vähkkasvaja, süsteemne erütematoosluupus, hemolüütilis- |
haigusseisundid |
ureemiline sündroom, krooniline põletikuline soolehaigus |
|
(Crohni tõbi või haavandiline koliit) ja sirprakuline aneemia. |
Vanuse tõus |
Eriti üle 35 aasta. |
Puudub üksmeel varikoossete veenide ja pindmise tromboflebiidi võimaliku rolli kohta venoosse tromboosi tekkimisel või progresseerumisel.
Arvestada tuleb trombemboolia tekkeriski suurenemist raseduse ajal ja eriti 6 nädala vältel pärast sünnitust (teavet raseduse ja imetamise kohta vt lõigust 4.6).
VTE sümptomid (süvaveenitromboos ja kopsuemboolia)
Sümptomite ilmnemisel tuleb soovitada naistele kohest arsti poole pöördumist ning tervishoiutöötajate teavitamist sellest, et ta kasutab
Süvaveenitromboosi sümptomid võivad olla:
−ühepoolne jala ja/või jalalaba paistetus või paistetus piki jalaveeni;
−valu või tundlikkus jalas, mis võib tunda anda ainult seistes või kõndides;
−haige jala kõrgem temperatuur, jalanaha punetus või värvimuutus.
Kopsuemboolia sümptomid võivad olla:
–äkki tekkinud ebaselge põhjusega õhupuudus või kiire hingamine;
–äkki tekkinud köha, millega võib kaasneda veriköha;
–terav valu rindkeres;
–tugev peapööritus või pearinglus;
–kiire või ebakorrapärane südamerütm.
Mõned nendest sümptomitest (nt õhupuudus, köha) on mittespetsiifilised ja neid võidakse ekslikult tõlgendada tavalisemate või vähemtõsiste haigustena (nt hingamisteede nakkused).
Veresoone sulgusele viitavad teised nähud võivad olla jäseme äkiline valu, paistetus ja kergelt sinine värvus.
Kui veresoone sulgus tekib silmas, võivad sümptomid varieeruda valutust hägustunud nägemisest kuni nägemiskaotuseni. Mõnikord võib nägemiskaotus tekkida peaaegu kohe.
Arteriaalse trombemboolia (ATE) risk
Epidemioloogilised uuringud on seostanud
ATE riskifaktorid
Riskifaktoritega
Tabel: ATE riskifaktorid
Riskifaktor |
Märkus |
Vanuse tõus |
Eriti üle 35 aasta. |
Suitsetamine |
Naistel tuleb soovitada mitte suitsetada, kui nad soovivad |
|
kasutada |
|
suitsetamist, tuleb tungivalt soovitada kasutada mõnda teist |
|
rasestumisvastast meetodit. |
Hüpertensioon |
|
Rasvumine (kehamassiindeks üle |
KMI tõusuga suureneb risk märkimisväärselt. |
30 kg/m²) |
Eriti oluline naistel, kellel esineb ka teisi riskifaktoreid. |
Esinemine perekonnas (arteriaalne |
Päriliku eelsoodumuse kahtluse korral tuleb enne mis tahes |
trombemboolia õdedel/vendadel või |
KHK määramise otsust saata naine eriarsti konsultatsioonile. |
vanematel, eriti just suhteliselt |
|
noores eas, nt enne 50. eluaastat) |
|
Migreen |
Migreeni esinemissageduse või raskusastme suurenemine (mis |
|
võib olla tserebrovaskulaarse häire varajaseks sümptomiks) |
|
KHK kasutamise ajal võib olla ravimi kasutamise kohese |
|
katkestamise põhjuseks. |
Teised vaskulaarsete häiretega |
Suhkurtõbi, hüperhomotsüsteineemia, südameklapi kahjustus |
seotud haigusseisundid |
ja kodade virvendus, düslipoproteineemia ja süsteemne |
|
erütematoosluupus. |
ATE sümptomid
Sümptomite ilmnemisel tuleb naistele soovitada kohest arsti poole pöördumist ning tervishoiutöötajate teavitamist sellest, et ta kasutab
Tserebrovaskulaarse haiguse sümptomid võivad olla:
–äkki tekkinud tuimus või nõrkus näos, käsivarres või jalas, eriti ühel kehapoolel;
–äkki tekkinud kõndimisraskus, pearinglus, tasakaalu- või koordinatsioonihäired;
–äkki tekkinud segasusseisund, rääkimis- või mõistmisraskus;
–äkki tekkinud nägemishäire ühes või mõlemas silmas;
–äkki tekkinud, tugev või pikaajaline teadmata põhjusega peavalu;
–teadvusekaotus või minestamine krampidega või ilma.
Ajutised sümptomid viitavad mööduvale isheemilisele atakile (TIA, transient ischaemic attack).
Müokardiinfarkti sümptomid võivad olla:
–valu, ebamugavustunne, survetunne, raskustunne, pigistus- või täistunne rindkeres, käsivarres või rinnaku all;
–ebamugavustunne, mis kiirgub selga, lõuga, kõripiirkonda, käsivarde, kõhtu;
–täistunne, seedehäired või lämbumistunne;
–higistamine, iiveldus, oksendamine või pearinglus;
–äärmine nõrkus, ärevus või õhupuudus;
–kiire või ebakorrapärane südamerütm.
Kasvajad
Mõnedes epidemioloogilistes uuringutes on pikaaegsetel (>5 aasta)
54 epidemioloogilise uuringu metaanalüüs näitas, et
Harvadel juhtudel on
Suureannuseliste
Kliinilistes uuringutes
Muud seisundid
Cleosensa’s sisalduv progestogeen on kaaliumi säästvate omadustega aldosterooni antagonist. Enamikul juhtudest ei esine kaaliumitaseme tõusu Ühes kliinilises uuringus suurenes siiski kerge või mõõduka neerukahjustustusega patsientidel vähesel määral, kuid mitte märkimisväärselt seerumi kaaliumitase kui drospirenooni võeti samaaegselt kaaliumi säästvate ravimitega. Seetõttu soovitatakse neerupuudulikkusega patsientidel, kellel seerumi kaaliumitase on enne ravi alustamist normi ülemisel piiril, kontrollida seerumi kaaliumitaset esimese ravitsükli ajal, seda eriti juhul, kui samaaegselt kasutatakse kaaliumisäästvaid ravimeid. Vt ka lõik 4.5.
Kuigi paljudel
Järgnevate seisundite ilmnemisest või ägenemisest on teatatud nii raseduse kui ka
Päriliku angioödeemiga naistel võivad eksogeensed östrogeenid esile kutsuda või ägestada angioödeemi sümptomeid.
Ägedate või krooniliste maksafunktsiooni häirete puhul võib ilmneda vajadus
Kuigi
Iga roosa tablett sisaldab 44 mg laktoosmonohüdraati, iga valge tablett sisaldab 89,5 mg laktoosmonohüdraati. Patsiendid, kellel on harvaesinev pärilik galaktoositalumatus, laktaasi puudulikkus või
Meditsiiniline läbivaatus/nõustamine
Enne Cleosensa kasutamise alustamist või taasalustamist tuleb võtta täielik meditsiiniline anamnees (sh perekonna anamnees) ja välistada rasedus. Vastunäidustustest (vt lõik 4.3) ja hoiatustest (vt lõik 4.4) lähtuvalt tuleb mõõta vererõhku ning teostada füüsiline läbivaatus. Oluline on juhtida naise tähelepanu venoosse ja arteriaalse tromboosiga seotud teabele, sh Cleosensa riskile võrreldes teiste
Naisi tuleb teavitada pakendi infolehe hoolika läbilugemise ja selles esitatud nõuannete järgimise vajadusest. Läbivaatuste sagedus ja iseloom peavad põhinema kehtivatel ravijuhistel ning need tuleb kohandada igale naisele individuaalselt.
Naisi tuleb teavitada sellest, et suukaudsed rasestumisvastased vahendid ei kaitse
Efektiivsuse vähenemine
Vähenenud tsükli kontroll
Kõikide
Kui veritsused jäävad ebakorrapärasteks või muutuvad ebakorrapärasteks pärast eelnevalt korrapäraseid tsükleid, tuleb arvestada mittehormonaalseid põhjuseid ja rakendada kohaseid diagnostilisi meetmeid halvaloomulise seisundi või raseduse välistamiseks. Nende hulka võib kuuluda ka emakaõõne puhastus.
Mõnel naisel ei pruugi platseebotablettide perioodil menstruatsioonilaadset vereeritust esineda. Juhul kui naine on võtnud
4.5Koostoimed teiste ravimitega ja muud koostoimed
Märkus: Võimalike koostoimete tuvastamiseks tuleb tutvuda samaaegselt manustatavate ravimite omaduste kokkuvõtetega.
-Teiste ravimite toimed Cleosensa’le
Koostoimed võivad ilmneda ravimitega, mis indutseerivad maksaensüüme ning mille tulemusena võib kiireneda suguhormoonide kliirens mis võib omakorda põhjustada nn läbimurdeveritsust ning/või rasestumisvastase toime ebaõnnestumist.
Kuidas toimida
Ensüümide induktsioon on märgatav juba mõnepäevase ravi järel. Maksimaalne ensüümide induktsioon ilmneb tavaliselt mõne nädala jooksul. Pärast ravikuuri lõppu võib ensüümide induktsioon püsida kuni 4 nädalat.
Lühiajaline ravi
Naised, kes võtavad samaaegselt ensüüme indutseerivaid ravimeid, peavad lisaks KSK’le kasutama ajutiselt barjäärimeetodit või mõnda muud rasestumisvastast meetodit. Barjäärimeetodit tuleb kasutada ravimite koosmanustamise vältel ning 28 päeva pärast ravi lõpetamist.
Kui ravimi võtmise aeg jätkub ka pärast toimeaineid sisaldavate tablettide lõppemist KSK pakendist, tuleb platseebotabletid hävitada ja kohe alustada uue KSK pakendiga.
Pikaajaline ravi
Kui naine saab pikaajalist ravi maksaensüüme indutseerivate toimeainetega, on soovitatav kasutada mõnda teist usaldusväärset, mittehormonaalset kontratseptsiooni meetodit.
Kirjanduses on kirjeldatud alljärgnevaid koostoimeid.
KSK’de kliirensit suurendavad ained (ensüümide induktsiooni tagajärjel väheneb KSK’de efektiivsus), nt:
barbituraadid, bosentaan, karbamasepiin, fenütoiin, primidoon, rifampitsiin ja
Ained, millel on erinevad toimed KSK’de kliirensile
KSK’dega koosmanustamisel võivad mitmed
Seetõttu tuleb võimalike koostoimete ja kaasuvate soovituste väljaselgitamiseks lugeda samaaegselt manustatavate
Drospirenooni peamised metaboliidid inimese vereseerumis moodustuvad ilma tsütokroom P450 süsteemi osaluseta. Seetõttu on ebatõenäoline, et selle ensüümsüsteemi inhibiitorid võiksid mõjutada drospirenooni metabolismi.
-Cleosensa toimed teistele ravimitele
Suukaudsed rasestumisvastased ravimid võivad mõjutada teatud teiste toimeainete metabolismi. Kontsentratsioonid plasmas ja kudedes võivad vastavalt kas suureneda (nt tsüklosporiin) või väheneda (nt lamotrigiin).
Tuginedes in vitro inhibitsiooniuuringutele ja in vivo koostoimete uuringutele vabatahtlike naispatsientidega, kes kasutasid markersubstraatidena omeprasooli, simvastatiini ja midasolaami, ei ole tõenäoline, et drospirenoon annuses 3 mg mõjutaks teiste toimeainete metabolismi.
Farmakodünaamilised koostoimed
Samaaegne kasutamine koos ombitasviiri/ paritapreviiri/ ritonaviiri ja dasabuviiri sisaldavate ravimitega, koos ribaviriiniga või ilma, võib suurendada transaminaaside (ALAT) aktiivsuse suurenemise riski (vt lõigud 4.3 ja 4.4). Seetõttu peavad Cleosensa kasutajad enne nimetatud kombinatsioonravi alustamist üle minema alternatiivsele kontratseptsiooni meetodile (nt ainult progesterooni sisaldav kontratseptiiv või mittehormonaalne vahend). Cleosensa kasutamist võib uuesti alustada 2 nädalat pärast nimetatud kombinatsioonravi lõpetamist.
-Muud koostoimed
Neerupuudulikkuseta patsientidel ei ilmnenud drospirenooni ja
-Laboratoorsed analüüsid
Rasestumisvastaste steroidide kasutamine võib mõjutada teatud laboratoorsete analüüside tulemusi, sh
4.6Fertiilsus, rasedus ja imetamine
Rasedus
Cleosensa ei ole näidustatud raseduse ajal.
Kui naine rasestub Cleosensa kasutamise ajal, tuleb ravimi manustamine viivitamatult lõpetada. Ulatuslikud epidemioloogilised uuringud ei ole näidanud suurenenud riski sünnidefektide tekkeks, kui ema on enne rasedust
Loomkatsetes on näidatud tiinuse ja imetamise ajal esinenud kõrvaltoimeid (vt lõik 5.3). Nendest loomkatsetest saadud andmete põhjal ei saa välistada toimeainete hormonaalsest aktiivsusest põhjustatud kõrvaltoimete olemasolu. Siiski, üldine kogemus
Saadaolevad andmed Cleosensa kasutamise kohta raseduse ajal on liiga piiratud ega võimalda seetõttu teha järeldusi Cleosensa kahjulike mõjude kohta rasedusele, loote või vastsündinu tervisele. Praegu puuduvad asjakohased epidemioloogilised andmed.
Sünnitusjärgsel perioodil tuleb arvesse võtta suurenenud VTE riski, kui taasalustatakse Cleosensa kasutamist (vt lõigud 4.2 ja 4.4).
Imetamine
Fertiilsus
Cleosensa on näidustatud raseduse vältimiseks. Teavet fertiilsuse taastumise kohta vt lõik 5.1.
4.7Toime reaktsioonikiirusele
Uuringuid ravimi toime kohta autojuhtimise ja masinate käsitsemise võimele ei ole läbi viidud. KSK- de kasutajatel ei ole täheldatud toimet autojuhtimise ja masinate käsitsemise võimele.
4.8Kõrvaltoimed
Seoses Cleosensa kasutamisega on teatatud järgnevatest kõrvaltoimetest:
Alltoodud tabelis on kõrvaltoimed jaotatud MedDRA organsüsteemi klasside kaupa. Esinemissagedused põhinevad kliiniliste uuringute andmetel. Reaktsiooni, selle sünonüümide ja seotud seisundite kirjeldamisel on kasutatud sobivaimaid MedDRA termineid.
Väga sage (≥1/10)
Sage (≥1/100 kuni <1/10)
Harv (≥1/10000 kuni <1/1000)
Väga harv (<1/10000)
Teadmata (ei saa hinnata olemasolevate andmete alusel)
Ravimi kõrvaltoimed, mida on seostatud Cleosensa kasutamisega suukaudse rasestumisvastase ravimina või mõõduka acne vulgarise ravis, on jaotatud MedDRA organsüsteemide klasside ning MedDRA terminite alusel.
Organsüsteemi |
Sage |
Harv |
Teadmata (ei |
|
klass |
|
|
|
saa hinnata |
(MedDRA |
(≥1/100 kuni |
(≥1/1000 |
(≥1/10000 kuni |
olemasolevate |
versioon 9.1) |
<1/10) |
kuni<1/100) |
<1/1000) |
andmete |
|
|
|
|
alusel) |
|
|
|
|
|
Infektsioonid ja |
|
|
Kandidiaas |
|
infestatsioonid |
|
|
|
|
Vere ja |
|
|
Aneemia |
|
lümfisüsteemi |
|
|
Trombotsüteemia |
|
häired |
|
|
|
|
Immuunsüsteemi |
|
|
Allergiline reaktsioon |
Ülitundlikkus |
häired |
|
|
|
|
Endokriinsüsteemi |
|
|
Endokriinsed häired |
|
häired |
|
|
|
|
Ainevahetus- ja |
|
|
Söögiisu tõus |
|
toitumishäired |
|
|
Anoreksia |
|
|
|
|
Hüperkaleemia |
|
|
|
|
Hüponatreemia |
|
Psühhiaatrilised |
Emotsionaalne |
Depressioon |
Anorgasmia |
|
häired |
labiilsus |
Närvilisus |
Unetus |
|
|
|
Somnolentsus |
|
|
Närvisüsteemi |
Peavalu |
Pearinglus |
Vertiigo |
|
häired |
|
Paresteesia |
Treemor |
|
Silma kahjustused |
|
|
Konjunktiviit |
|
|
|
|
Silmade kuivus |
|
|
|
|
Silmade häired |
|
Südame häired |
|
|
Tahhükardia |
|
Vaskulaarsed |
|
Migreen |
Flebiit |
|
häired |
|
Veenilaiendid |
Vaskulaarsed häired |
|
|
|
Hüpertensioon |
Ninaverejooks |
|
|
|
|
Sünkoop |
|
Organsüsteemi |
Sage |
Harv |
Teadmata (ei |
|
klass |
|
|
|
saa hinnata |
(MedDRA |
(≥1/100 kuni |
(≥1/1000 |
(≥1/10000 kuni |
olemasolevate |
versioon 9.1) |
<1/10) |
kuni<1/100) |
<1/1000) |
andmete |
|
|
|
|
alusel) |
|
|
|
|
|
|
|
|
Venoosne |
|
|
|
|
trombemboolia |
|
|
|
|
Arteriaalne |
|
|
|
|
trombemboolia |
|
Seedetrakti häired |
Iiveldus |
Kõhuvalu |
Kõhu suurenemine |
|
|
|
Oksendamine |
Seedetrakti häired |
|
|
|
Düspepsia |
Täistunne seedetraktis |
|
|
|
Kõhupuhitus |
Hiaatuse song |
|
|
|
Gastriit |
Suuõõne kandidiaas |
|
|
|
Kõhulahtisus |
Kõhukinnisus |
|
|
|
|
Suukuivus |
|
Maksa ja sapiteede |
|
|
Biliaarne valu |
|
häired |
|
|
Koletsüstiit |
|
Naha ja |
|
Akne |
Kloasmid |
Erythema |
nahaaluskoe |
|
Sügelus |
Ekseem |
multiforme |
kahjustused |
|
Lööve |
Alopeetsia |
|
|
|
|
Dermatitis acneiform |
|
|
|
|
Nahakuivus |
|
|
|
|
Nodoosne erüteem |
|
|
|
|
Hüpertrihhoos |
|
|
|
|
Naha kahjustus |
|
|
|
|
Nahastriiad |
|
|
|
|
Kontaktdermatiit |
|
|
|
|
Fotosensitiivne |
|
|
|
|
dermatiit |
|
|
|
|
Nahapaapulid |
|
|
Seljavalu |
|
|
|
sidekoe |
|
Jäsemete valu |
|
|
kahjustused |
|
Lihaskrambid |
|
|
Reproduktiivse |
Rinnavalu |
Vaginaalne |
Düspareuunia |
|
süsteemi ja |
Metrorraagia* |
kandidiaas |
Vulvovaginiit |
|
rinnanäärme |
Amenorröa |
Vaagnavalu |
Seksuaalvahekorra- |
|
häired |
|
Rindade suurenemine |
järgne verejooks |
|
|
|
Fibrotsüstilised |
Menstruatsioonide |
|
|
|
muutused |
vaheline verejooks |
|
|
|
rinnanäärmetes |
Rinnanäärme tsüstid |
|
|
|
Verejooks |
Rinnanäärme |
|
|
|
emakast/tupest* |
hüperplaasia |
|
|
|
Voolus suguteedest |
Rinnanäärme kasvaja |
|
|
|
Kuumahood |
Emakakaela polüüp |
|
|
|
Vaginiit |
Endomeetriumi |
|
|
|
Menstruatsioonihäired |
atroofia |
|
|
|
Düsmenorröa |
Munasarjatsüst |
|
|
|
Hüpomenorröa |
Emaka suurenemine |
|
|
|
Menorraagia |
|
|
|
|
Tupekuivus |
|
|
|
|
|
|
|
|
|
tulemus |
|
|
|
|
Libiido langus |
|
|
Üldised häired ja |
|
Asteenia |
Üldine halb |
|
manustamiskoha |
|
Suurenenud |
enesetunne |
|
Organsüsteemi |
Sage |
Harv |
Teadmata (ei |
|
klass |
|
|
|
saa hinnata |
(MedDRA |
(≥1/100 kuni |
(≥1/1000 |
(≥1/10000 kuni |
olemasolevate |
versioon 9.1) |
<1/10) |
kuni<1/100) |
<1/1000) |
andmete |
|
|
|
|
alusel) |
|
|
|
|
|
reaktsioonid |
|
higistamine |
|
|
|
|
Tursed |
|
|
|
|
(generaliseerunud |
|
|
|
|
tursed, perifeersed |
|
|
|
|
tursed, näoturse) |
|
|
Uuringud |
|
Kehakaalu tõus |
Kehakaalu langus |
|
|
|
|
|
|
*ebaregulaarsed veritsused taanduvad tavaliselt ravi käigus
Valitud kõrvaltoimete kirjeldus
-Suurem risk arteriaalsete ning venoossete trombootiliste ja trombembooliliste seisundite, sh müokardiinfarkti, insuldi, mööduva isheemilise ataki, venoosse tromboosi ja kopsuemboolia tekkeks. Neid seisundeid on põhjalikumalt kirjeldatud lõigus 4.4.
-Hüpertoonia.
-Maksakasvajad.
-Haigusseisundite ilmnemine või süvenemine, mille korral seost
-Kloasmid.
-Maksafunktsiooni ägedate või krooniliste häirete ilmnemisel võib olla vajalik
-Päriliku angioödeemiga naistel võivad eksogeensed östrogeenid esile kutsuda või ägestada angioödeemi sümptomeid.
Suukaudsete rasestumisvastaste ravimite kasutajate seas diagnoositakse rinnavähki veidi sagedamini. Kuivõrd rinnavähki esineb alla
Koostoimed
Suukaudsete kontratseptiivide ja teiste ravimite (ensüümide indutseerijad) koostoimete tulemusena võib tekkida tsüklivälist verejooksu ja/või kontratseptsiooni ebaõnnestumist (vt lõik 4.5).
Võimalikest kõrvaltoimetest teavitamine
Ravimi võimalikest kõrvaltoimetest on oluline teavitada ka pärast ravimi müügiloa väljastamist. See võimaldab jätkuvalt hinnata ravimi kasu/riski suhet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest kõrvaltoimetest www.ravimiamet.ee kaudu.
4.9Üleannustamine
Praeguseks puuduvad teated Cleosensa üleannustamise kohta. Kombineeritud suukaudsete kontratseptiivide kasutamisel saadud üldiste kogemuste alusel võivad tablettide üleannustamisel tekkida järgmised sümptomid: iiveldus, oksendamine ja noortel tüdrukutel vähene tupekaudne verejooks. Antidoodid puuduvad, edasine ravi on sümptomaatiline.
5.FARMAKOLOOGILISED OMADUSED
5.1Farmakodünaamilised omadused
Farmakoterapeutiline rühm: gestageenide ja östrogeenide fikseeritud kombinatsioonid.
Meetodi ebaõnnestumise Pearli indeks: 0,41 (ülemine kahepoolne 95% usalduspiir: 0,85). Üldine Pearli indeks (meetodi viga + patsiendi viga): 0,80 (ülemine kahepoolne 95 % usalduspiir: 1,30).
Cleosensa rasestumisvastane toime põhineb erinevate tegurite koostoimel, millest tähtsaimateks on ovulatsiooni pärssimine ja emaka limaskesta muutused.
Kolme tsükli jooksul teostatud ovulatsiooni pärssimise uuringus, milles võrreldi 3 mg drospirenooni/0,02 mg etünüülöstradiooli kasutamist
Cleosensa on kombineeritud suukaudne rasestumisvastane ravim, mis sisaldab etünüülöstradiooli ja drospirenooni (progestageen). Terapeutilistes annustes on drospirenoonil ka antiandrogeensed ja kerged antimineralokortikoidsed omadused. Drospirenoonil puudub östrogeenne, glükokortikoidne ja antiglükokortikoidne toime. Sellest tulenevalt sarnaneb drospirenooni farmakoloogiline profiil suuresti loodusliku progesterooni omaga.
Kliiniliste uuringute tulemused viitavad, et Cleosensa kerged antimineralokortikoidsed omadused põhjustavad kergeid antimineralokortikoidseid toimeid.
Hindamaks etünüülöstradiooli/drospirenooni tõhusust ja ohutust mõõduka raskusega acne vulgaris’ega naistel, viidi läbi kaks mitmekeskuselist topeltpimedat randomiseeritud platseebokontrolliga uuringut.
Pärast kuus kuud kestnud ravi vähendas etünüülöstradiool/drospirenoon võrreldes platseeboga statistiliselt oluliselt rohkem põletikulisi lesioone 15,6% (49,3% versus 33,7%), mittepõletikulisi lesioone 18,5% (40,6% versus 22,1%) ja lesioonide koguarvu 16,5% (44,6% versus 28,1%). Lisaks oli 11,8% (18,6% versus 6,8%) suurem ka isikute osakaal, kellel oli Investigator’s Static Global Assessment (ISGA) skaala alusel „nahk puhas” või „nahk praktiliselt puhas”.
5.2 Farmakokineetilised omadused
Drospirenoon
Imendumine
Suukaudsel manustamisel imendub drospirenoon kiirelt ja peaaegu täielikult. Toimeaine maksimaalsed kontsentratsioonid seerumis (ligikaudu 38 ng/ml) saavutatakse preparaadi ühekordse manustamise järel ligikaudu 1...2 tunniga. Biosaadavus on vahemikus 76...85%. Toidu samaaegne manustamine drospirenooni biosaadavust ei mõjuta.
Jaotumine
Suukaudse manustamise järgselt langevad drospirenooni tasemed seerumis lõpliku poolestusajaga
31 tundi. Drospirenoon seotakse seerumi albumiiniga ja see ei seondu suguhormooni siduva globuliini (SHBG, sex hormone binding globulin) ega kortikoidi siduva globuliiniga (CBG, corticoid binding globulin). Vaid 3...5% kogu toimeaine seerumi kontsentratsioonist esineb vaba steroidina. Etünüülöstradiooli poolt põhjustatud SHBG tõus ei mõjuta drospirenooni seondumist seerumi valguga. Drospirenooni keskmine näiline jaotusruumala on 3,7 ± 1,2 l/kg.
Biotransformatsioon
Suukaudse manustamise järel metaboliseerub drospirenoon ulatuslikult. Põhilised metaboliidid plasmas on drospirenooni happelised vormid, mis tekivad laktoonringi avanemisel, ja
Eritumine
Drospirenooni metaboolne kliirens seerumis on 1,5 ± 0,2 ml/min/kg. Drospirenoon eritub muutumatul kujul vaid tühistes kogustes. Drospirenooni metaboliidid erituvad rooja ja uriiniga vahekorras ligikaudu 1:2 kuni 1:4. Uriini ja roojaga erituvate metaboliitide poolväärtusaeg on ligikaudu 40 tundi.
Tasakaalukontsentratsioon
Ravitsükli ajal saavutatakse drospirenooni maksimaalsed tasakaalukontsentratsioonid seerumis ligikaudu 70 ng/ml, mis saavutatakse ligikaudu
Patsientide erirühmad
Neerufunktsiooni häire mõju
Kerge neerukahjustusega naistel (kreatiniini kliirens CLcr 50...80 ml/min) olid drospirenooni püsikontsentratsioonid seerumis võrreldavad normaalse neerufunktsiooniga naiste omadega. Mõõduka neerukahjustusega naistel (CLcr 30...50 ml/min) olid drospirenooni kontsentratsioonid seerumis normaalse neerufunktsiooniga naiste omadega võrreldes keskmiselt 37% võrra kõrgemad. Samuti oli drospirenoonravi kerge ja mõõduka neerukahjustusega naistele hästi talutav. Drospirenoonravi ei mõjutanud kaaliumi seerumikontsentratsioone kliiniliselt olulisel määral.
Maksafunktsiooni häire mõju
Normaalse maksafunktsiooniga isikutega võrreldes vähenes üksikannusega uuringus osalevate mõõduka maksakahjustusega vabatahtlikel kliirens suukaudsel manustamisel (CL/F) ligikaudu 50% võrra. Mõõduka maksakahjustusega vabatahtlikel täheldatud drospirenooni kliirensi langus ei põhjustanud nähtavaid erinevusi seerumi kaaliumikontsentratsioonides. Isegi diabeedi ja samaaegse spironolaktoonravi korral (kaks tegurit, mis soodustavad hüperkaleemia teket) ei täheldatud seerumi kaaliumikontsentratsioonide tõusu üle normaalse vahemiku ülempiiri. Sellest võib järeldada, et kerge ja mõõduka maksakahjustusega
Etnilised rühmad
Jaapanlannadel ja helenahalistel naistel ei täheldatud drospirenooni ega etünüülöstradiooli farmakokineetikas kliiniliselt olulisi erinevusi.
Etünüülöstradiool
Imendumine
Suukaudsel manustamisel imendub etünüülöstradiool kiirelt ja täielikult. Pärast ühekordset suukaudset manustamist saavutatakse maksimaalne kontsentratsioon seerumis (ligikaudu 33 pikogrammi/ml) 1...2 tunniga. Presüsteemse konjugatsiooni ja esmase maksapassaaži tulemusena on absoluutne biosaadavus ligikaudu 60%. Koos toiduga manustamisel vähenes etünüülöstradiooli biosaadavus ligikaudu 25% uuringus osalejatest, samas kui ülejäänutel vastavaid muutusi ei täheldatud.
Jaotumine
Seerumi etünüülöstradiooli tase väheneb kahefaasiliselt, lõplikku dispositsioonifaasi iseloomustab ligikaudu
Biotransformatsioon
Etünüülöstradiooli presüsteemne konjugatsioon leiab aset nii peensoole limaskestas kui ka maksas. Etünüülöstradiooli esmane metabolism toimub aromaatse hüdroksüülimise kaudu, kuid moodustub ka mitmesuguseid hüdroksüülitud ja metüülitud metaboliite, mis esinevad nii vabade metaboliitide kui ka
glükuroniidide ning sulfaatide konjugaatidena. Etünüülöstradiooli metaboolne kliirens on ligikaudu 5 ml/min/kg.
Eritumine
Etünüülöstradiool ei eritu olulisel määral muutumatul kujul. Etünüülöstradiooli metaboliidid erituvad uriini ja sapiga vahekorras 4:6. Metaboliitide eritumise poolväärtusaeg on ligikaudu 1 päev.
Tasakaalukontsentratsioon
Püsiv ravimi plasmakontsentratsioon saavutatakse ravitsükli teises pooles ning etünüülöstradiooli seerumitase tõuseb ligikaudu 2,0...2,3 korda.
5.3Prekliinilised ohutusandmed
Laboriloomadel piirdusid drospirenooni ja etünüülöstradiooli toimed teadaolevate farmakoloogiliste toimetega. Eelkõige näitasid reproduktiivtoksilisuse uuringud loomadel embrüotoksilist ja lootetoksilist toimet. Neid toimeid peetakse liigispetsiifiliseks. Kui annused olid suuremad kui Cleosensa kasutajatel, täheldati roti loodetel mõju soolisele diferentseerumisele, kuid ahvidel sellist toimet ei täheldatud.
6.FARMATSEUTILISED ANDMED
6.1Abiainete loetelu
Toimeainetega tabletid (roosad tabletid):
Tableti sisu:
Laktoosmonohüdraat
Eelželatiniseeritud (maisi)tärklis
Povidoon
Naatriumkroskarmelloos
Polüsorbaat 80
Magneesiumstearaat (E572)
Tableti kate:
Osaliselt hüdrolüüsitud polüvinüülalkohol
Titaandioksiid (E171)
Makrogool 3350
Talk (E553b)
Kollane raudoksiid (E172)
Punane raudoksiid (E172)
Must raudoksiid (E172)
Platseebotabletid (valged tabletid):
Tableti sisu:
Veevaba laktoos
Povidoon
Magneesiumstearaat (E572)
Tableti kate:
Osaliselt hüdrolüüsitud polüvinüülalkohol
Titaandioksiid (E171)
Makrogool 3350
Talk (E553b)
6.2Sobimatus
Ei kohaldata.
6.3Kõlblikkusaeg
3 aastat.
6.4Säilitamise eritingimused
See ravimpreparaat ei vaja säilitamisel eritingimusi.
6.5Pakendi iseloomustus ja sisu
Alumiiniumist
Pakendi suurused:
1 x 28 õhukese polümeerikattega tabletti (24 toimeainetega tabletti pluss 4 platseebotabletti). 2 x 28 õhukese polümeerikattega tabletti (24 toimeainetega tabletti pluss 4 platseebotabletti). 3 x 28 õhukese polümeerikattega tabletti (24 toimeainetega tabletti pluss 4 platseebotabletti). 6 x 28 õhukese polümeerikattega tabletti (24 toimeainetega p tabletti luss 4 platseebotabletti). 13 x 28 õhukese polümeerikattega tabletti (24 toimeainetega tabletti pluss 4 platseebotabletti).
Kõik pakendi suurused ei pruugi olla müügil.
6.6Erihoiatused ravimpreparaadi hävitamiseks ja käsitlemiseks
Kasutamata ravimpreparaat või jäätmematerjal tuleb hävitada vastavalt kohalikele nõuetele.
7.MÜÜGILOA HOIDJA
Actavis Group PTC ehf
Reykjavíkurvegi
Island
8.MÜÜGILOA NUMBER
9.ESMASE MÜÜGILOA VÄLJASTAMISE/MÜÜGILOA UUENDAMISE KUUPÄEV
Müügiloa esmase väljastamise kuupäev: 28.02.2014
10.TEKSTI LÄBIVAATAMISE KUUPÄEV
November 2017
