Strattera - kõvakapsel (100mg) - Ravimi omaduste kokkuvõte
Artikli sisukord
RAVIMI OMADUSTE KOKKUVÕTE
1.RAVIMPREPARAADI NIMETUS
Strattera, 10 mg kõvakapslid
Strattera, 18 mg kõvakapslid
Strattera, 25 mg kõvakapslid
Strattera, 40 mg kõvakapslid
Strattera, 60 mg kõvakapslid
Strattera, 80 mg kõvakapslid
Strattera, 100 mg kõvakapslid
2.KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS
Üks kõvakapsel sisaldab atomoksetiinvesinikkloriidi, mis vastab 10 mg, 18 mg, 25 mg, 40 mg, 60 mg, 80 mg või 100 mg atomoksetiinile.
INN: Atomoxetinum
Abiainete täielik loetelu vt lõik 6.1.
3.RAVIMVORM
Kõvakapsel.
Strattera 10 mg kõvakapslid on läbipaistmatud valged ja nende kaanele on musta tindiga trükitud “Lilly 3227” ning kehale “10 mg”, kapslite pikkus ligikaudu 15,5...16,1 mm.
Strattera 18 mg kõvakapslid on kuldsed (kaas) ja läbipaistmatud valged (keha) ning kaanele on musta tindiga trükitud “Lilly 3238” ja kehale “18 mg”, kapslite pikkus ligikaudu 15,5...16,1 mm.
Strattera 25 mg kõvakapslid on tumesinised (kaas) ja läbipaistmatud valged (keha) ning kaanele on musta tindiga trükitud “Lilly 3228” ja kehale “25 mg”, kapslite pikkus ligikaudu 15,5...16,1 mm. Strattera 40 mg kõvakapslid on tumesinised ja nende kaanele on musta tindiga trükitud “Lilly 3229” ja kehale “40 mg”, kapslite pikkus ligikaudu 15,5...16,1 mm.
Strattera 60 mg kõvakapslid on tumesinised (kaas) ja kuldsed (keha) ning kaanele on musta tindiga trükitud “Lilly 3239” ja kehale “60 mg”, kapslite pikkus ligikaudu 17,5...18,1 mm.
Strattera 80 mg kõvakapslid on tumepruunid (kaas) ja läbipaistmatud valged (keha) ning kaanele on musta tindiga trükitud “Lilly 3250” ja kehale “80 mg”, kapslite pikkus ligikaudu 17,5...18,1 mm. Strattera 100 mg kõvakapslid on tumepruunid (kaas) ja kaanele on musta tindiga trükitud “Lilly 3251” ja kehale “100 mg”, kapslite pikkus ligikaudu 19,2...19,8 mm.
4.KLIINILISED ANDMED
4.1Näidustused
Aktiivsus- ja tähelepanuhäire (ADHD) ravi vähemalt
Täiskasvanutel peavad eelnevalt lapseeas esinenud ADHD sümptomid olema kinnitust leidnud. Kolmanda osapoole kinnitus on soovitav ja
Lisainformatsioon selle preparaadi ohutuks kasutamiseks
Kompleksravi hõlmab tavaliselt psühholoogilisi, pedagoogilisi ja sotsiaalseid abinõusid ning selle eesmärgiks on käitumishäirete sündroomiga patsientide stabiliseerimine. Käitumishäirete sündroom võib sisaldada anamneesis pikaajaliselt selliseid sümptomeid nagu halb tähelepanu maht, tähelepanu hajutatavus, emotsionaalne labiilsus, impulsiivsus, mõõdukas või raskekujuline hüperaktiivsus, kergemad neuroloogilised sümptomid ja kõrvalekalle
Farmakoteraapia ei ole näidustatud kõigile selle sündroomiga patsientidele ning otsus seda ravimit kasutada peab põhinema patsiendi sümptomite ja häirete raskusastme väga põhjalikul analüüsil, arvestades patsiendi vanust ja sümptomite püsimist.
4.2Annustamine ja manustamisviis
Annustamine
Strattera’t võib manustada ööpäevase üksikannusena hommikul. Patsientidele, kel ei saavutata rahuldavat ravivastust (taluvust [nt iiveldus või somnolentsus] või efektiivsust) Strattera manustamisel üks kord ööpäevas, võib paremini sobida ravimi manustamine kahe võrdse osana hommikul ja hilisel pärastlõunal või varajasel õhtul.
Lapsed
Annustamine alla 70 kg kehakaaluga lastel
1,2 mg/kg/ööpäevas korral ei ole täiendavat kasu täheldatud. Suuremate annuste kui üksikannused 1,8 mg/kg/ööpäevas ja ööpäevased koguannused 1,8 mg/kg ohutust ei ole süstemaatiliselt hinnatud. Mõnedel juhtudel võib vajalikuks osutuda ravi jätkamine täiskasvanueas.
Annustamine üle 70 kg kehakaaluga lastel
Täiskasvanud
Lisainformatsioon selle preparaadi ohutuks kasutamiseks:
Enne ravimi määramist on vajalik võtta piisav anamnees ja anda patsiendi kardiovaskulaarse seisundi ravieelne hinnang, sh vererõhu väärtus ja pulsisagedus (vt lõigud 4.3 ja 4.4).
Jätkuv jälgimine:
Vajalik on kardiovaskulaarse seisundi regulaarne jälgimine koos vererõhu väärtuse ja pulsisageduse salvestamisega annuse igakordse kohandamise järel ning seejärel korrata seda vähemalt iga 6 kuu järel. Laste puhul on soovitatav kasutada pertsentiilide tabelit. Täiskasvanute puhul tuleb jälgida kehtivaid hüpertensiooni ravijuhiseid (vt lõik 4.4).
Ravi ärajätmine:
Uuringuprogrammis ei ole täheldatud ilmseid ärajätusümptomeid. Oluliste kõrvaltoimete tekkimisel võib atomoksetiinravi järsult katkestada, muidu on soovitatav ravi lõpetamisel annust teatava aja jooksul
Eripopulatsioonid
Maksapuudulikkus: mõõduka maksapuudulikkusega patsientidel
Neerupuudulikkus: lõppstaadiumis neeruhaigusega patsientidel tuvastati süsteemselt tsirkuleeriva atomoksetiini suurem hulk kui normaalse neerufunktsiooniga inimestel (ligikaudu 65 % suurem), kuid erinevust ei esinenud siis, kui annust korrigeeriti mg/kg alusel. Seega võib Strattera’t manustada aktiivsus- ja tähelepanuhäirega patsientidele, kel esineb lõppstaadiumis neeruhaigus või neerupuudulikkuse kergemad astmed, tavalise annustamisskeemi alusel. Lõppstaadiumis neeruhaigusega patsientidel võib atomoksetiin ägestada arteriaalset hüpertensiooni (vt lõik 5.2).
Ligikaudu 7
Eakad: atomoksetiini kasutamist ei ole üle
Alla
Manustamisviis
Suukaudseks kasutamiseks. Strattera’t võib manustada olenemata söögiaegadest.
4.3Vastunäidustused
Ülitundlikkus toimeaine või lõigus 6.1 loetletud mis tahes abiainete suhtes.
Atomoksetiini ei tohi kasutada koos monoaminooksüdaasi inhibiitoritega (MAO inhibiitoritega). Atomoksetiini ei tohi kasutada vähemalt 2 nädala jooksul pärast MAO inhibiitorite kasutamise lõpetamist. Ravi MAO inhibiitoritega ei tohi alustada varem kui 2 nädalat pärast atomoksetiinravi lõppu.
Atomoksetiini ei tohi kasutada kinnise nurga glaukoomiga patsientidel, kuna kliinilistes uuringutes kaasnes atomoksetiini kasutamisega müdriaasi esinemissageduse suurenemine.
Atomoksetiini ei tohi kasutada raske südameveresoonkonna või tserebrovaskulaarse häirega patsientidel (vt lõik 4.4 Erihoiatused ja ettevaatusabinõud kasutamisel – Kardiovaskulaarsed toimed). Südameveresoonkonna raske häire all mõistetakse rasket hüpertensiooni, südamepuudulikkust, arterite sulgust, stenokardiat, hemodünaamiliselt olulist kaasasündinud südamehaigust, kardiomüopaatiaid, müokardiinfarkti, potentsiaalselt eluohtlikku arütmiat ja
Atomoksetiini ei tohi kasutada feokromotsütoomiga või anamneesis feokromotsütoomiga patsiendid (vt lõik 4.4 Erihoiatused ja ettevaatusabinõud kasutamisel – Kardiovaskulaarsed toimed).
4.4Erihoiatused ja ettevaatusabinõud kasutamisel
Suitsidaalne käitumine
Atomoksetiiniga ravitud patsientidel on täheldatud suitsidaalset käitumist (suitsiidikatsed ja suitsiidimõtted). Topeltpimedates kliinilistes uuringutes esines suitsidaalseid juhte
Äkksurm ja eelnev kardiaalne hälve
Atomoksetiini tavaannustes kasutanud struktuurse kardiaalse hälbega patsientidel on teatatud äkksurmast. Kuigi mõned tõsised struktuursed kardiaalsed hälbed ise põhjustavad kõrgemat riski äkksurma tekkeks, tohib atomoksetiini teadaoleva tõsise struktuurse kardiaalse hälbega patsientidel kasutada ainult erilise ettevaatusega ning kardioloogiga konsulteerides.
Kardiovaskulaarsed toimed
Atomoksetiin võib mõjutada pulsisagedust ja vererõhku.
Enamus atomoksetiini võtvatest patsientidest kogeb mõõdukat pulsisageduse kiirenemist (keskmiselt <10 lööki/minutis) ja/või vererõhu tõusu (keskmiselt <5 mm/Hg) (vt lõik 4.8).
Siiski näitavad ADHD kontrollitud ja mittekontrollitud kliinilistest uuringutest saadud kombineeritud andmed, et ligikaudu 8…12 % lastest ja noorukitest ning 6...10% täiskasvanutest kogevad tugevalt väljendunud pulsisageduse (20 või enam lööki minutis) ning vererõhu muutusi (15…20 või enam mm/Hg). Nende kliiniliste uuringute andmete analüüs näitas, et ligikaudu 15…26 % lastest ja noorukitest ning 27...32% täiskasvanutest kogeb
Nende leidude tulemuste tõttu tuleb patsientidelt, kellele on kavatsetud määrata
Enne ravi algust, ravi ajal ja pärast annuse igakordset korrigeerimist ning seejärel vähemalt iga 6 kuu järel on soovitatav mõõta ja salvestada pulsisagedust ja vererõhu väärtusi, et tuvastada paremini võimalikku kliiniliselt olulist tõusu. Laste puhul on soovitatav kasutada pertsentiilide tabelit. Täiskasvanute puhul tuleb jälgida kehtivaid hüpertensiooni ravijuhiseid.
Atomoksetiini ei tohi kasutada raske kardiovaskulaarse või tserebrovaskulaarse häirega patsiendid (vt lõik 4.3 Vastunäidustused – Südameveresoonkonna või tserebrovaskulaarse raske häirega patsiendid). Atomoksetiini tuleb kasutada ettevaatusega patsientidel, kelle kaasuv haigus võib vererõhu tõusu ja pulsisageduse kiirenemise tõttu halveneda, nt hüpertoonikud, tahhükardia või kardiovaskulaarse või tserebrovaskulaarse haigusega patsiendid.
Patsiendid, kes kogevad atomoksetiinravi ajal südamehaigusele viitavaid sümptomeid, nt palpitatsioonid, pingutusel valu rinnus, seletamatud minestamised, düspnoe või teised sümptomid, peaksid minema koheselt kardioloogi juurde erialasele konsultatsioonile.
Lisaks tuleb atomoksetiini kasutada ettevaatusega kaasasündinud või omandatud pika
Kuna teatatud on ka ortostaatilise hüpotensiooni tekkest, tuleb atomoksetiini kasutada ettevaatusega mistahes seisundi korral, mis võivad patsiendil soodustada hüpotensiooni teket või seisundite korral, mis on seotud järskude südamerütmi või vererõhu muutustega.
Tserebrovaskulaarsed toimed
Tserebrovaskulaarsete seisundite lisariskifaktoritega patsientidel (nt anamneesis kardiovaskulaarne haigus, kaasuv ravi vererõhku tõstvate ravimitega), tuleb pärast ravi alustamist atomoksetiiniga iga visiidi ajal hinnata neuroloogilisi nähte ja sümptomeid.
Toimed maksale
Väga harva on olnud spontaanseid teateid maksakahjustusest, mis on väljendunud maksaensüümide aktiivsuse tõusus ja bilirubiinitaseme tõusus koos ikterusega. Samuti on väga harva teatatud raskest maksakahjustusest, sh ägedast maksapuudulikkusest. Ikteruse või laboratoorselt kinnitatud maksakahjustusega patsientidel tuleb Strattera manustamine lõpetada ega tohi enam uuesti alustada.
Psühhootilised või maniakaalsed sümptomid
Ravi atomoksetiini tavaannustega võib põhjustada ilma eelneva psüühilise või maniakaalse haiguseta patsientidel psühhootilisi või maniakaalseid sümptomeid, nt hallutsinatsioone, pettekujutelmi, maniat või agiteeritust. Selliste sümptomite ilmnemisel tuleb kaaluda nende võimalikku seost atomoksetiin- raviga ning vajadusel ravi katkestada. Ei saa välistada võimalust, et Strattera võib põhjustada eelnevalt olemasolevate psühhootiliste või maniakaalsete sümptomite ägenemist.
Agressiivne käitumine, vaenulikkus või emotsionaalne labiilsus
Vaenulikkust (eeskätt agressiivsust, vastuolulist käitumist ja viha) täheldati kliinilistes uuringutes sagedamini Strattera`ga ravitud lastel, noorukitel ja täiskasvanutel, võrreldes platseeboga. Lastega läbiviidud kliinilistes uuringutes täheldati Stratterat saanud lastel emotsionaalset labiilsust sagedamini kui platseebot saanutel. Patsiente tuleb tähelepanelikult jälgida agressiivse käitumise, vaenulikkuse või emotsionaalse labiilsuse ilmnemise või halvenemise osas.
Võimalikud allergilised reaktsioonid
Atomoksetiini kasutavatel patsientidel on
Krambid
Atomoksetiiniga kaasneb potentsiaalne krampide tekke risk. Atomoksetiini tuleb ettevaatusega kasutama hakata patsientidel, kellel on varem esinenud krampe. Atomoksetiinravi lõpetamist peaks kaaluma iga patsiendi puhul, kellel tekivad krambid või juhul, kui krampide esinemissagedus suureneb ning selleks ei ole mingit muud põhjust avastatud.
Kasv ja areng
Atomoksetiinravi ajal tuleb jälgida laste ja noorukite kasvu ja arengut. Pikaajalist ravi vajavaid patsiente tuleb jälgida ning laste ja noorukite puhul, kes ei kasva või ei võta piisavalt kaalus juurde, tuleb kaaluda annuse vähendamist või ravi katkestamist.
Kliinilised andmed ei osuta atomoksetiini kahjulikele toimetele seoses kognitiivse arengu või sugulise küpsemisega, kuid pikaajaliste vaatlusandmete hulk on piiratud. Seetõttu tuleb pikaajalist ravi saavaid patsiente hoolikalt jälgida.
Kaasuva depressiooni, ärevuse ja tikkide uued hood või seisundi halvenemine
ADHD ja kaasuvate krooniliste motoorsete tikkidega või Tourette’i sündroomiga pediaatrilistel patsientidel läbi viidud kontrollitud uuringus ei halvendanud atomoksetiin platseeboga võrreldes tikke. ADHD ja kaasuva depressiooniga täiskasvanud patsientidel läbi viidud kontrollitud uuringus ei halvendanud atomoksetiin platseeboga võrreldes depressiooni.
Kahes ADHD ja kaasuva ärevushäirega patsientidega läbi viidud kontrollitud uuringus (üks lastega ja teine täiskasvanutega) ei halvendanud atomoksetiin platseeboga võrreldes ärevushäiret.
Turuletulekujärgselt on olnud harva teateid ärevuse ja depressiooni või depressiivse meeleolu ja väga harva tikkide esinemise kohta atomoksetiini tarvitavatel patsientidel (vt lõik 4.8).
Patsiente, kellel juba ravitakse
Alla 6 aasta vanused lapsed
Strattera’t ei tohi alla 6 aasta vanustel patsientidel kasutada, sest ravimi ohutust ja efektiivsust selles patsientide vanusegrupis ei ole tõestatud.
Muu terapeutiline kasutamine
Strattera ei ole näidustatud depressiivsete episoodide ja/või ärevuse raviks, kuna nende täiskasvanute seas, kellel ei esinenud
4.5Koostoimed teiste ravimitega ja muud koostoimed
Teiste ravimite toimed atomoksetiinile
MAO inhibiitorid
Atomoksetiini ei tohi koos MAO inhibiitoritega kasutada (vt lõik 4.3).
CYP2D6 inhibiitorid
Neid ravimeid saavatel patsientidel võib atomoksetiini ekspositsioon 6…8 korda suureneda ja Css max on 3…4 korda kõrgem, sest ta metaboliseerub CYP2D6 kaasabil. Patsientidel, kes juba kasutavad CYP2D6 inhibiitoreid, võib osutuda vajalikuks aeglasem tiitrimine ja atomoksetiini väiksem lõplik annus. Kui pärast atomoksetiini sobiva annuse väljatiitrimist ordineeritakse või jäetakse ära CYP2D6 inhibiitor, tuleb antud patsiendil kliinilist vastust ja taluvust uuesti hinnata, otsustamaks, kas on vaja annuse korrigeerimist.
Samaaegne tsütokroom P450 inhibiitorite manustamine aeglastele CYP2D6 abil metaboliseerijatele peaks toimuma ettevaatusega, kuna kliiniliselt oluliste tõusude toime atomoksetiini avaldumises on in vivo uuringutest teadmata.
Salbutamool (või teised beeta2 agonistid)
Patsientidele, kes kasutavad samaaegselt salbutamooli (või teiste beeta2 agonistide) suuri annuseid kas nebulisaatori kaudu või süsteemselt, tuleb atomoksetiini manustada ettevaatusega, kuna toime kardiovaskulaarsüsteemile võib tugevneda.
Selle koostoime kohta on leitud vasturääkivaid fakte. Süsteemselt manustatud salbutamool
(600 mikrogrammi i.v. 2 tunni järel) kombinatsioonis atomoksetiiniga (60 mg kaks korda ööpäevas, 5 päeva) tekitab pulsisageduse kiirenemise ja vererõhu tõusu. See toime avaldus kõige ilmekamalt salbutamooli ja atomoksetiini algsel koosmanustamisel, kuid taandus algväärtusele 8 tunni möödudes. Kuid eraldi uuringus tervete asiaatidest täiskasvanutega, kes on atomoksetiini kiired metaboliseerijad, ei suurenenud siiski salbutamooli toimed vererõhule ja pulsisagedusele tavaannuste
(200 mikrogrammi) inhaleerimisel atomoksetiini (80 mg üks kord ööpäevas 5 päeva vältel) koosmanustamisel. Salbutamooli korduva inhaleerimise (800 mikrogrammi) järel oli pulsisagedus samasugune nii atomoksetiini kasutamisel kui ka mittekasutamisel.
Kui atomoksetiini või salbutamooli (või teiste beeta2 agonistide) koosmanustamise ajal on südame löögisagedus või vererõhk märkimisväärselt tõusnud, tuleb vererõhku ja südame löögisagedust tähelepanelikult jälgida ning vajadusel annust kohandada.
QT intervalli pikenemise potentsiaalne risk esineb juhul, kui atomoksetiini manustatakse koos teiste
tsisapriid), elektrolüütide hulga tasakaalutust põhjustavate ravimitega (nagu nt tiasiiddiureetikumid) ja
Atomoksetiini kasutamisega kaasneb potentsiaalne krampide tekke risk. Ettevaatusega tuleb atomoksetiiniga samaaegselt kasutada krampide esinemissagedust vähendavaid ravimeid (nagu nt tritsüklilised antidepressandid või
Antihüpertensiivsed ravimid
Atomoksetiini tuleb kasutada ettevaatusega koos antihüpertensiivsete ravimitega. Vererõhu võimaliku tõusu tõttu võib atomoksetiin vähendada antihüpertensiivsete ravimite/hüpertensiooni ravimite efektiivsust. Tähelepanu tuleb pöörata vererõhu kontrollile ja vajadusel tuleb atomoksetiini või antihüpertensiivne ravi üle vaadata ning vererõhu märkimisväärsete muutuste korral annuseid kohandada.
Pressoorsed ained ja vererõhku tõstvad ravimid
Vererõhu võimaliku tõusu tõttu tuleb atomoksetiini ettevaatusega kasutada koos pressoorsete ainete või ravimitega, mis võivad vererõhku tõsta (nt salbutamool). Vererõhu jälgimisel on vajalik ettevaatus ja vajadusel tuleb atomoksetiini või pressoorsete ainete ravi üle vaadata ning vererõhu märkimisväärsete muutuste korral annuseid kohandada.
Noradrenaliini toimet mõjutavad ravimid
Noradrenaliini toimet mõjutavaid ravimeid tuleb koos atomoksetiiniga kasutada ettevaatusega, kuna esineb farmakoloogiliste toimete summeerumise või sünergismi võimalus. Selliste ravimite hulka kuuluvad antidepressandid nagu imipramiin, venlafaksiin ja mirtasapiin ning nina limaskestade turset alandav aine pseudoefedriin või fenüülefriin.
Mao
Mao
Suure valguseonduvusega ravimid
Atomoksetiini ja teiste suure seonduvusega ravimite terapeutiliste kontsentratsioonidega viidi in vitro läbi ravimi sidumiskohast väljatõrjumise uuringud. Varfariin, atsetüülsalitsüülhape, fenütoiin või diasepaam ei mõjutanud atomoksetiini seondumist inimese albumiinidega. Samuti ei mõjutanud atomoksetiin nende ühendite seondumist inimese albumiiniga.
4.6Fertiilsus, rasedus ja imetamine
Rasedus
Loomkatsed ei näita üldiselt otsest kahjulikku toimet rasedusele, embrüo/loote arengule, sünnitusele või postnataalsele arengule (vt lõik 5.3). Atomoksetiini kasutamise kohta rasedatel on andmeid piiratud hulgal. Need andmed on ebapiisavad otsustamaks kas atomoksetiini ja kahjuliku toime vahel rasedusele ja/või imetamisele on seos või see seos puudub. Atomoksetiini ei tohi raseduse ajal kasutada, kui võimalik kasu emale ei ületa ohtu lootele.
Imetamine
Atomoksetiin ja/või selle metaboliidid eritusid rottidel emapiima. Ei ole teada, kas atomoksetiin eritub inimese rinnapiima. Andmete puudumise tõttu ei tohi atomoksetiini rinnaga toitmise ajal kasutada.
4.7Toime reaktsioonikiirusele
Andmed ravimi toime kohta autojuhtimisele ja masinate käsitsemise võimele on piiratud. Stratteral on kerge toime autojuhtimise ja masinate käsitsemise võimele. Atomoksetiini on seostatud väsimuse, unisuse ja pearingluse tekke suurenemisega lastel ja täiskasvanutel võrreldes platseeboga. Patsientidel
tuleb soovitada autojuhtimisel või ohtlike masinate kasutamisel olla eriti ettevaatlik, kuni nad ei ole täiesti kindlad, et atomoksetiin ei ole nende tähelepanuvõimet kahjustanud.
4.8Kõrvaltoimed
Lapsed:
Ohutusprofiili kokkuvõte
Lastega läbiviidud platseebokontrollitud uuringutes olid kõige sagedamini esinevateks atomoksetiiniga seotud kõrvaltoimeteks peavalu, kõhuvalu1 ja söögiisu vähenemine, mida on registreeritud vastavalt 19
Koos söögiisu vähenemisega esineb mõnel patsiendil ravi alguses kasvu pidurdumine (aeglustumine) nii kaalu kui ka pikkuse näitajates. Enamasti, pärast esialgset kehakaalu ja kehapikkuse tõusu aeglustumist saavutasid atomoksetiiniga ravitud patsiendid grupi algandmete põhjal ette nähtud keskmise kehakaalu ja kehapikkuse tõusu pikaajalise ravi jooksul.
Iiveldus, oksendamine ja unisus2 võivad esineda ligikaudu 10…11
Nii laste kui täiskasvanutega läbiviidud platseebokontrollitud uuringutes täheldati atomoksetiini kasutavatel patsientidel südame löögisageduse kiirenemist, süstoolse ja diastoolse vererõhu tõusu (vt lõik 4.4).
Atomoksetiini kasutavatel patsientidel on registreeritud ortostaatilist hüpotensiooni (0,2 %) ja sünkoopi (0,8 %), kuna aine mõjutab noradrenergilist toonust. Igasuguste hüpotensiooni soodustavate seisundite korral tuleb atomoksetiini kasutada ettevaatusega.
Järgnev kõrvaltoimete tabel põhineb kõrvaltoimetest teatamisel ning laboratoorsetel leidudel kliinilistest uuringutest ja kõrvaltoime teadetest turuletulekujärgselt lastel ja noorukitel.
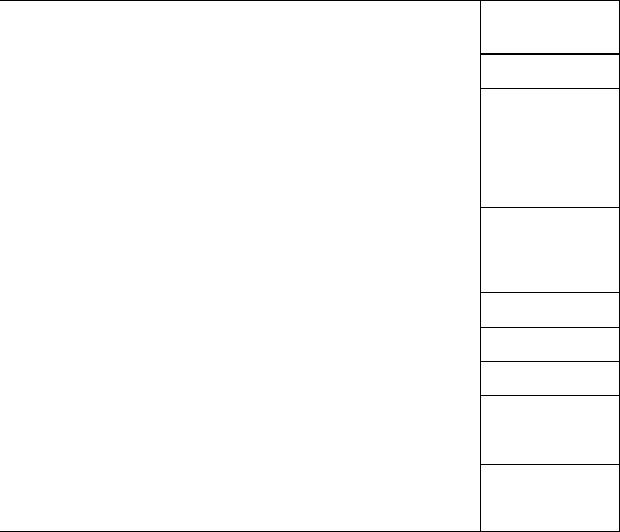
Kõrvaltoimete tabelkokkuvõte
Esinemissagedus: väga sage (≥ 1/10), sage (≥ 1/100 kuni < 1/10),
Organsüsteemi |
Väga sage |
Sage |
Harv |
|
klass |
≥1/10 |
≥ 1/100 kuni |
≥ 1/1000 kuni |
≥ 1/10000 kuni |
|
|
< 1/10 |
< 1/100 |
< 1/1000 |
Vähenenud |
Anoreksia |
|
|
|
toitumishäired |
söögiisu |
(söögiisu |
|
|
|
|
puudumine |
|
|
Psühhiaatrilised |
|
Ärrituvus, |
Suitsidaalne |
|
häired |
|
meeleolu |
käitumine, |
|
|
|
muutused, |
agressiivsus, |
|
|
|
unetus, |
vaenulikkus, |
|
|
|
agiteeritus*, |
emotsionaalne |
|
|
|
ärevus, |
labiilsus*, psühhoos |
|
|
|
depressioon ja |
(sh |
|
|
|
depressiivne |
hallutsinatsioonid)* |
|
|
|
meeleolu*, |
|
|
|
|
tikid* |
|
|
Närvisüsteemi |
Peavalu, |
Pearinglus |
Sünkoop, treemor, |
|
häired |
unisus |
|
migreen, |
|
|
|
|
paresteesia*, |
|

|
|
|
hüpesteesia*, |
|
|
|
krambid** |
Silma |
|
Müdriaas |
Ähmane nägemine |
kahjustused |
|
|
|
Südame häired |
|
|
Palpitatsioonid, |
|
|
|
siinustahhükardia, |
|
|
|
QT intervalli |
|
|
|
pikenemine** |
Vaskulaarsed |
|
|
|
häired |
|
|
|
Respiratoorsed, |
|
|
Düspnoe (vt lõik |
rindkere ja |
|
|
4.4) |
mediastiinumi |
|
|
|
häired |
|
|
|
Seedetrakti |
Kõhuvalu, |
Kõhukinnisus, |
|
häired |
oksendamine, |
düspepsia |
|
|
iiveldus |
|
|
Maksa ja |
|
|
Bilirubiinisisalduse |
sapiteede häired |
|
|
tõus veres* |
|
|
|
|
Naha ja |
|
Dermatiit, |
Hüperhidroos, |
nahaaluskoe |
|
pruuritus, |
allergilised |
kahjustused |
|
lööve |
reaktsioonid |
Neerude ja |
|
|
|
kuseteede häired |
|
|
|
Reproduktiivse |
|
|
|
süsteemi ja |
|
|
|
rinnanäärme |
|
|
|
häired |
|
|
|
Üldised häired ja |
|
Väsimus, |
Asteenia |
manustamiskoha |
|
letargia, valu |
|
reaktsioonid |
|
rinnus (vt lõik |
|
|
|
4.4) |
|
Uuringud |
Vererõhu |
Kehakaalu |
|
|
tõus, |
langus |
|
|
pulsisageduse |
|
|
|
kiirenemine |
|
|
Raynaud’ sündroom
Maksaensüümide aktiivsuse muutused/tõus, ikterus, hepatiit, maksakahjustus, äge maksapuudulikkus*
Urineerimisraskus, kusepeetus
Priapism, genitaalide valu meestel
Siia kuulub ka ülakõhuvalu, ebamugavustunne maos, kõhuõõnes ja ülakõhus
Siia kuulub ka sedatsioon
Siia kuulub algne, kesköine ja varajane unetus (varahommikused ärkamised)
Pulsisageduse ja vererõhu leiud põhinevad mõõdetud elulistel näitajatel |
*Vt lõik 4.4
** Vt lõigud 4.4 ja 4.5.
CYP2D6 aeglased metaboliseerijad (AM)
Järgnevaid kõrvaltoimeid täheldati vähemalt 2
tel); enurees (3,0 %
Täiskasvanud:
Ohutusprofiili kokkuvõte
Täiskasvanud ADHD patsientidega läbiviidud kliinilistes uuringutes esines ravi ajal atomoksetiiniga järgmistes organsüsteemi klassides kõrvaltoimeid kõige suurema esinemissagedusega: seedetrakti, närvisüsteemi ja psühhiaatrilised häired. Kõige sagedamini teatatud kõrvaltoimed (≥5%) olid söögiisu vähenemine (14,9%), unetus (11,3%), peavalu (16,3%), suukuivus (18,4%) ja iiveldus (26,7%). Enamus nendest kõrvaltoimetest olid tõsiduselt kerged või mõõdukad ning nendest omakorda kõige sagedamini teatati raskekujulisest iiveldusest, unetusest, väsimusest ja peavalust.. Täiskasvanutel tuleb kusepeetuse või urineerimisraskuse esinemisel selle võimaliku põhjusena arvestada atomoksetiinravi.
Järgnev kõrvaltoimete tabel põhineb kõrvaltoimetest teatamisel ning laboratoorsetel leidudel kliinilistest uuringutest ja kõrvaltoime teatistest turuletulekujärgselt täiskasvanutel.
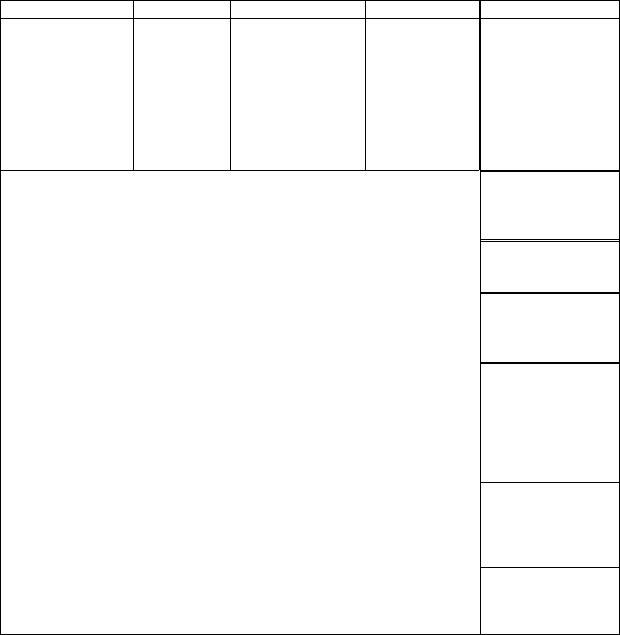
Kõrvaltoimete tabelkokkuvõte
Esinemissagedus: väga sage (≥ 1/10), sage (≥ 1/100 kuni < 1/10),
Organsüsteemi |
Väga sage |
Sage |
|
klass |
≥ 1/10 |
≥ 1/100 kuni < 1/10 |
≥ 1/1000 kuni |
|
|
|
< 1/100 |
Ainevahetus- ja |
Vähenenud |
|
|
toitumishäired |
söögiisu |
|
|
Psühhiaatrilised |
Unetus |
Agiteeritus*, libiido |
Suitsidaalne |
häired |
|
langus, unehäired, |
käitumine*, |
|
|
depressioon ja |
agressiivsus, |
|
|
depressiivne |
vaenulikkus ja |
|
|
meeleolu*, ärevus |
emotsionaalne |
|
|
|
labiilsus*, |
|
|
|
rahutus, tikid* |
Närvisüsteemi |
Peavalu |
Pearinglus, |
Sünkoop, |
häired |
|
düsgeuusia, |
migreen, |
|
|
paresteesia, |
hüpesteesia* |
|
|
somnolentsus (sh |
|
|
|
sedatsioon), treemor |
|
Silma kahjustused |
|
|
Hägune |
|
|
|
nägemine |
Südame häired |
|
Palpitatsioonid, |
QT intervalli |
|
|
tahhükardia |
pikenemine** |
Vaskulaarsed |
|
Nahaõhetus, |
Perifeerne |
häired |
|
kuumahood |
külmatunne |
Respiratoorsed, |
|
|
Düspnoe (vt lõik |
rindkere ja |
|
|
4.4) |
mediastiinumi |
|
|
|
häired |
|
|
|
Seedetrakti häired |
Suukuivus, |
Kõhuvalu, |
|
|
iiveldus |
kõhukinnisus, |
|
|
|
düspepsia, |
|
|
|
kõhupuhitus, |
|
|
|
|
|
Harv
≥1/10000 kuni <1/1000
Psühhoosid (sh hallutsinatsioonid)*
Krambid**
Raynaud’ sündroom
oksendamine
Maksa ja sapiteede häired
Naha ja |
|
Dermatiit, |
Allergilised |
nahaaluskoe |
|
hüperhidrooos, |
reaktsioonid, |
kahjustused |
|
lööve |
pruuritus, |
|
|
|
urtikaaria |
|
|
Lihasspasmid |
|
sidekoe |
|
|
|
kahjustused |
|
|
|
Neerude ja |
|
Düsuuria, |
Kusepakitsus |
kuseteede häired |
|
pollakisuuria, |
|
|
|
urineerimisraskus, |
|
|
|
kusepeetus |
|
Reproduktiivse |
|
Düsmenorröa, |
Ejakulatsiooni |
süsteemi ja |
|
ejakulatsiooni |
puudus, |
rinnanäärme |
|
häired, |
ebaregulaarne |
häired |
|
erektsioonihäired, |
menstruatsioon, |
|
|
prostatiit, |
ebanormaalne |
|
|
genitaalide valu |
orgasm |
|
|
meestel |
|
Üldised häired ja |
|
Asteenia, väsimus, |
Külmatunne. |
manustamiskoha |
|
letargia, |
Valu rinnus (vt |
reaktsioonid |
|
külmavärinad, |
lõik 4.4) |
|
|
närviline olek, |
|
|
|
ärrituvus, janu |
|
Uuringud |
Vererõhu |
Kehakaalu langus |
|
|
tõus, |
|
|
|
pulsisageduse |
|
|
|
kiirenemine |
|
|
Maksaensüümide aktiivsuse muutused/tõus, ikterus, hepatiit, maksakahjustus, äge maksapuudulikkus, vere bilirubiinisisalduse tõus*
Priapism
Siia kuulub ka ülakõhuvalu, ebamugavustunne maos, kõhuõõnes ja ülakõhus.
Siia kuulub algne, kesköine ja varajane (varahommikuse ärkamisega) unetus.
Pulsisageduse ja vererõhu leiud põhinevad mõõdetud elulistel näitajatel.
Siia kuuluvad anafülaktilised reaktsioonid ja angioneurootiline turse. |
*Vt lõik 4.4
** Vt lõigud 4.4 ja 4.5.
CYP2D6 aeglased metaboliseerijad (AM)
Järgnevaid kõrvaltoimeid täheldati vähemalt 2
Võimalikest kõrvaltoimetest teavitamine
Ravimi võimalikest kõrvaltoimetest on oluline teavitada ka pärast ravimi müügiloa väljastamist. See võimaldab jätkuvalt hinnata ravimi kasu/riski suhet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest kõrvaltoimetest www.ravimiamet.ee kaudu.
4.9Üleannustamine
Sümptomid
Turuletulekujärgselt on teatatud atomoksetiini monoteraapia mitteletaalsetest ägedatest ja kroonilistest üleannustamistest. Ägedate ja krooniliste üleannustamistega kõige sagedamini kaasnevateks sümptomiteks on olnud gastrointestinaalsed sümptomid, unisus, pearinglus, treemor ja käitumishäired. Teatatud on ka hüperaktiivsusest ja agiteeritusest. Samuti täheldati sümpaatilise närvisüsteemi aktivatsiooniga seotud kergeid kuni mõõduka raskusega nähte (nt tahhükardia, vererõhu tõus, pupillide laienemine, suukuivus) ning on saadud teateid ka nahasügeluse ja
Seoses atomoksetiini üleannustamisega on kliiniline kogemus piiratud.
Ravi
Tuleb tagada vabad hingamisteed. Ühe tunni jooksul pärast üleannuse sisse võtmist võib olla kasu aktiveeritud söe manustamisest, et takistada ravimi imendumist. Soovitatav on kardiaalsete ja eluliste funktsioonide jälgimine ning sobivate sümptomaatiliste ja toetavate meetmete rakendamine. Patsienti tuleb jälgida vähemalt 6 tunni jooksul. Kuna atomoksetiin seondub suurel määral plasmavalkudega, siis dialüüsist üleannustamise ravis tõenäoliselt kasu ei ole.
5.FARMAKOLOOGILISED OMADUSED
5.1Farmakodünaamilised omadused
Farmakoterapeutiline rühm: psühhoanaleptikumid, tsentraalse toimega sümpatomimeetikumid
Toimemehhanism ja farmakodünaamilised toimed
Atomoksetiini toimemehhanism põhineb arvatavasti väga selektiivsel ja tugeval presünaptilise noradrenaliini transportija inhibeerimisel, ilma otsese mõjuta serotoniini või dopamiini transportijatele. Atomoksetiinil on minimaalne afiinsus teiste noradrenergiliste retseptorite või teiste neuromediaatorite transportijate või retseptorite suhtes. Atomoksetiinil on kaks peamist oksüdatiivset metaboliiti:
Atomoksetiin ei ole psühhostimulant ega amfetamiini derivaat. Täiskasvanutega läbiviidud randomiseeritud, topeltpimedas, platseebokontrollitud, kuritarvitamise potentsiaali uuringutes, milles võrreldi atomoksetiini toimeid platseeboga, ei tuvastatud atomoksetiinil sellist ravivastuse mudelit, mis oleks osutanud stimuleerivatele või euforiseerivatele omadustele.
Kliiniline efektiivsus ja ohutus
Lapsed
Strattera’t on uuritud uuringutes, mis hõlmasid üle 5000 lapse ja nooruki, kel esines ADHD. Strattera lühiajalist efektiivsust ADHD ravis hinnati esialgselt kuues randomiseeritud, topeltpimedas, platseebokontrollitud, kuue- kuni üheksanädalase kestusega uuringus. ADHD sümptomite hindamiseks võrreldi Strattera- ja
Lisaks tõestati
Strattera oli efektiivne nii ööpäevase üksikannusena kui ka kahe osaannusena, mida manustati hommikul ja hilisel pärastlõunal/varajasel õhtul. Õpetajate ja lapsevanemate hinnangust lähtuvalt kaasnes Strattera manustamisega üks kord ööpäevas statistiliselt oluliselt suurem ADHD sümptomite raskusastme vähenemine võrreldes platseeboga.
Aktiivsed võrdlusuuringud
Randomiseeritud, topeltpimedas, paralleelgruppidega,
Täiskasvanud
Strattera’t on uuritud kliinilistes uuringutes üle
Tabel X Efektiivsuse näitajate keskmised muutused platseebokontrollitud uuringutes
|
|
Muutused võrreldes algväärtusega vähemalt ühes algväärtuse järgses näitajas |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
AAQoL |
|||||
|
|
|
AISRSA |
|||||
Uuring |
Ravi |
N |
Keskmine |
Keskmine |
Keskmine |
|||
|
|
|
muutus |
|
muutus |
|
muutus |
|
Akuutne uuring |
|
|
|
|
|
|
|
|
LYAA |
ATX |
0,006 |
0,011 |
- |
- |
|||
|
PBO |
|
|
|
|
|||
LYAO |
ATX |
0,002 |
0,002 |
- |
- |
|||
|
PBO |
|
|
|
|
|||
LYBY |
ATX |
0,007 |
0,048 |
- |
- |
|||
|
PBO |
|
|
|
|
|||
LYDQ |
ATX |
<0,001 |
0,022 |
14,9 |
0,030 |
|||
|
PBO |
|
|
11,1 |
|
|||
LYDZ |
ATX |
<0,001 |
<0,001 |
15,8 |
0,005 |
|||
|
PBO |
|
|
11,0 |
|
|||
LYEE |
ATX |
<0,001 |
<0,001 |
12,83 |
<0,001 |
|||
|
PBO |
|
|
8,20 |
|
|||
Pikaajaline uuring |
|
|
|
|
|
|
|
|
LYBV |
ATX |
0,412 |
0,173 |
13,90 |
0,045 |
|||
|
PBO |
|
|
11,18 |
|
|||
LYCU |
ATX |
0,005 |
0,001 |
13,14 |
0,004 |
|||
|
PBO |
|
|
8,62 |
|
|||
LYCW |
ATX |
<0,001 |
<0,001 |
- |
- |
|||
|
PBO |
|
|
|
|
|||
Lühendite tähendus: AAQoL = Täiskasvanute ADHD elukvaliteedi koguskoor; AISRS = Täiskasvanute ADHD uurija sümptomite hindamise skaala koguskoor; ATX = atomoksetiin;
A ADHD sümptomite skaalad; tulemused, mis on näidatud uuringule LYBY on AISRS jaoks; tulemused kõikide teiste jaoks on
Tundlikkuse analüüsis, kus patsientidel, kellel ei tehtud algtasemejärgset hindamist (st kõik ravitud patsiendid), kasutati
Kliiniliselt olulise ravivastuse analüüsis kõigis 6 akuutses uuringus ja mõlemas edukas pikaajalises uuringus, kus kasutati mitmeid a priori ja post hoc definitsioone, täheldati atomoksetiiniga ravitud patsientidel püsivalt statistiliselt oluliselt kõrgemat ravivastuse määra võrreldes platseebot saanud patsientidega (Tabel Y).
Tabel Y Patsientide arv (n) ja protsent, kes vastasid ühendatud platseebokontrolliga uuringute ravivastuse kriteeriumitele
|
|
Ravivastus, mis on määratletud |
Ravivastus, mis on määratletud |
||||
|
|
paranemisega vähemalt ühes CGI- |
|
||||
|
|
|
S punktis |
|
tulemusnäitja40% paranemisega |
||
Grupp |
Ravi |
N |
n (%) |
N |
n (%) |
||
|
|
|
|
|
|
|
|
Ühendatud akuutsed uuringudA |
|
|
|
|
|
|
|
|
ATX |
401 (62,7%) |
<0,001 |
347 (41,3%) |
<0,001 |
||
|
PBO |
283 (43,4%) |
|
215 (25,3%) |
|
||
Ühendatud pikaajalised uuringud |
|
|
|
|
|
|
|
|
ATX |
482 (63,6%) |
<0,001 |
292 (44,0%) |
<0,001 |
||
|
PBO |
301 (49,3%) |
|
175 (31,4%) |
|
||
A sisaldab kõiki Tabelis X olevaid uuringuid, va: Akuutne
Kahes nendest akuutsetest uuringutest uuriti ADHD ja kaasuva alkoholismi või sotsiaalse ärevushäirega patsiente ja mõlemas uuringus täheldati ADHD sümptomite paranemist. Uuringus kaasuva alkoholi kuritarvitamisega patsientidega puudus erinevus atomoteksiini ja platseebogruppide vahel alkoholi tarbimiskäitumise suhtes. Uuringus kaasuva ärevushäirega patsientidega kaasuv ärevusseisund
Atomoksetiini efektiivsust sümptomite allumise säilitamisel näidati uuringus, kus pärast
platseebot saanud patsientidega (64,3 % vs. 50,0%; p=0,001). Atomoksetiiniga ravitud patsientidel näidati statistiliselt oluliselt paremat funktsioonide säilimist võrreldes platseebot saanutega - seda näidati väiksema keskmise muutusena täiskasvanute ADHD elukvaliteedi (AAQoL) koguskoorile 3- kuulise intervalli (p=0,003) ja
QT/QTc uuring
Põhjalikus QT/QTc uuringus, mis viidi läbi tervete täiskasvanutega, kes olid aeglased CYP2D6 metaboliseerijad (AM), manustati kuni 60 mg atomoksetiini kaks korda ööpäevas. Näidati, et maksimaalse oodatava kontsentratsiooni korral ei erinenud atomoksetiini toime
5.2Farmakokineetilised omadused
Atomoksetiini farmakokineetika lastel ja noorukitel on sarnane täiskasvanute omaga. Atomoksetiini farmakokineetikat ei ole uuritud alla 6 aasta vanustel lastel.
Farmakokineetilised uuringud näitavad, et atomoksetiini kapslid ja suukaudne lahus on bioekvivalentsed.
Imendumine: Atomoksetiin imendub pärast suukaudset manustamist kiiresti ja peaaegu täielikult, kusjuures keskmine maksimaalne tuvastatud kontsentratsioon plasmas (CMAX) saabub ligikaudu 1...2 tundi pärast manustamist. Atomoksetiini absoluutne biosaadavus pärast suukaudset manustamist on 63 %...94 %, sõltuvalt individuaalsest erinevusest üldiselt vähese esmase maksapassaži osas. Atomoksetiini võib manustada söögiajast sõltumatult.
Jaotumine: Atomoksetiin jaotub ulatuslikult ning seondub suurel määral (98 %) plasmavalkude, peamiselt albumiiniga.
Biotransformatsioon: Atomoksetiin allub biotransformatsioonile, peamiselt tsütokroom P450 2D6 (CYP2D6) ensümaatilist rada pidi. 7
Tsütokroom P450 ensüümid: Atomoksetiin ei põhjustanud tsütokroom P450 ensüümide, sh CYP1A2, CYP3A, CYP2D6 ja CYP2C9, kliiniliselt olulist inhibeerimist ega indutseerimist.
Eritumine: Atomoksetiini keskmine eliminatsiooni poolväärtusaeg pärast suukaudset manustamist on kiiretel metaboliseerijatel 3,6 tundi ja aeglastel metaboliseerijatel 21 tundi. Atomoksetiin eritub peamiselt
Lineaarsus/mittelineaarsus: nende annuste ulatuses, mida on uuritud nii kiiretel kui aeglastel metaboliseerijatel, on atomoksetiini farmakokineetika lineaarne.
Eripopulatsioonid
Maksakahjustuse korral on atomoksetiini kliirens vähenenud, süsteemne ekspositsioon suurenenud (AUC suureneb mõõduka maksakahjustuse korral 2 korda ja raske maksakahjustuse korral 4 korda), ning eelravimi poolväärtusaeg - võrreldes tervete vabatahtlikega, kellel on CYP2D6 kiire metabolismi genotüüp sarnane - pikenenud. Mõõduka kuni raske maksakahjustusega (Child Pugh B ja C klass) patsientidel on vaja alg- ja lõplikku annust kohandada (vt lõik 4.2).
Lõppstaadiumis neeruhaigusega (ESRD) patsientidel on atomoksetiini keskmised plasmakontsentratsioonid üldiselt kõrgemad kui tervetel isikutel saadud keskmised kontrollväärtused, näidates Cmax (7% erinevus) ja
kohandamist vastavalt kehakaalule olid gruppidevahelised erinevused minimaalsed. Atomoksetiini ja tema metaboliitide farmakokineetika lõppstaadiumis neeruhaigusega patsientidel viitab asjaolule, et annust ei ole vaja kohandada (vt lõik 4.2).
5.3Prekliinilised ohutusandmed
Farmakoloogilise ohutuse, korduvtoksilisuse, genotoksilisuse, kartsinogeensuse või reproduktsioonitoksilisuse traditsioonilised prekliinilised uuringud ei ole näidanud kahjulikku toimet inimesele. Seoses annuse piirangutega, mida on tinginud kliiniline (või ülemäärane farmakoloogiline) vastus ravimile loomadel koos metaboolsete erinevustega liikide lõikes, kutsusid mittekliinilistes uuringutes kasutatud maksimaalsed talutavad annused loomadel esile tsirkuleeriva atomoksetiini koguse, mis oli samasugune või veidi suurem kui see, mille saavutavad aeglased CYP2D6 metaboliseerijad maksimaalse soovitatava ööpäevase annuse korral.
Hindamaks atomoksetiini toimet kasvule ning neurokäitumuslikule ja seksuaalsele arengule, viidi läbi uuring noorte rottidega. Täheldati kerget hilinemist tupe arengus (kõigi annuste korral) ja eesnaha eraldumises (≥ 10 mg/kg/ööpäevas) ning vähest munandimanuste kaalu ja spermatosoidide arvu langust (≥ 10 mg/kg/ööpäevas), kuid ei avastatud toimeid sigivusele ega reproduktiivsele funktsioonile. Nende leidude tähtsus inimesele ei ole teada.
Tiineid küülikuid raviti atomoksetiini annustega kuni 100 mg/kg/ööpäevas, mida manustati makku kunstliku toitmise sondi kaudu kogu organogeneesi perioodil. Selle annuse puhul täheldati 1 uuringus kolmest, loote elulemuse vähenemist, varajase resorptsiooni sagenemist, unearteri ebatüüpilise lähtekoha ning rangluualuse arteri puudumise vähest sagenemist. Neid leide tuvastati selliste annuste korral, mis põhjustasid emal kerget toksilisust. Nende leidude esinemissagedus jäi varasemate kontrollväärtuste piiridesse. Neid leide mittepõhjustav annus oli 30 mg/kg/ööpäevas. Seondumata atomoksetiini AUC küülikutel oli annuse 100 mg/kg/ööpäevas puhul ligikaudu 3,3 korda (CYP2D6 kiiretel metaboliseerijatel) ja 0,4 korda (CYP2D6 aeglastel metaboliseerijatel) suurem kui inimestel, kes on saanud maksimaalse ööpäevase annuse 1,4 mg/kg/ööpäevas. Kolmest
6.FARMATSEUTILISED ANDMED
6.1Abiainete loetelu
Preželatiniseeritud maisitärklis
Dimetikoon
Kapsli kest: Naatriumlaurüülsulfaat Želatiin
Kapsli kesta kaane värvained: 10 mg: titaandioksiid E171
18 mg: kollane raudoksiid E172
25 mg, 40 mg ja 60 mg: FD&C Blue 2 (indigokarmiin) E132 ja titaandioksiid E171
80 mg ja 100 mg: kollane raudoksiid E172, punane raudoksiid E172, titaandioksiid E171
Kapsli kesta keha värvained: 60 mg: kollane raudoksiid E172
10 mg, 18 mg, 25 mg ja 80 mg: titaandioksiid E171
40 mg: FD&C Blue 2 (indigokarmiin) E132 ja titaandioksiid E171
100 mg: kollane raudoksiid E172, punane raudoksiid E172, titaandioksiid E171
Must toiduvärv
6.2Sobimatus
Ei kohaldata.
6.3Kõlblikkusaeg
3 aastat
6.4Säilitamise eritingimused
See ravimpreparaat ei vaja säilitamisel eritingimusi.
6.5Pakendi iseloomustus ja sisu
Polüvinüülkloriid (PVC)/polüetüleen (PE)/polüklorotrifluoroetüleen, PCTFE blister, kaetud alumiiniumfooliumiga.
Pakendid 7, 14, 28 ja 56 kapsliga. Kõik pakendi suurused ei pruugi olla müügil.
6.6Erihoiatused ravimpreparaadi hävitamiseks
Kapslid ei ole mõeldud avamiseks. Atomoksetiinil on silma ärritav toime. Kapsli sisu silma sattumisel tuleb kahjustatud silma loputada otsekohe veega ning küsida meditsiinilist nõuannet. Käsi ja saastunud pindu tuleb esimesel võimalusel pesta.
7.MÜÜGILOA HOIDJA
Eli Lilly Holdings Limited Lilly House,
Priestley Road,
Basingstoke,
RG24 9NL Ühendkuningriik
8.MÜÜGILOA NUMBRID
Strattera, 10 mg kõvakapslid: 499305
Strattera, 18 mg kõvakapslid: 499505
Strattera, 25 mg kõvakapslid: 499605
Strattera, 40 mg kõvakapslid: 499205
Strattera, 60 mg kõvakapslid: 499705
Strattera, 80 mg kõvakapslid: 593008
Strattera, 100 mg kõvakapslid: 592908
9.ESMASE MÜÜGILOA VÄLJASTAMISE/MÜÜGILOA UUENDAMISE KUUPÄEV
Müügiloa esmase väljastamise kuupäev:
Strattera, 10 mg: 11.11.2005
Strattera, 18 mg: 11.11.2005
Strattera, 25 mg: 11.11.2005
Strattera, 40 mg: 11.11.2005
Strattera, 60 mg: 11.11.2005
Strattera, 80 mg: 22.08.2008
Strattera, 100 mg: 22.08.2008
Müügiloa viimase uuendamise kuupäev:
Strattera, 10 mg: 06.03.2015
Strattera, 18 mg: 06.03.2015
Strattera, 25 mg: 06.03.2015
Strattera, 40 mg: 06.03.2015
Strattera, 60 mg: 06.03.2015
Strattera, 80 mg: 06.03.2015
Strattera, 100 mg: 06.03.2015
10.TEKSTI LÄBIVAATAMISE KUUPÄEV
juuni 2015
Täpne teave selle ravimpreparaadi kohta on kättesaadav Eesti Ravimiameti kodulehel.
