Feiba - süstelahuse pulber ja lahusti (1000ühik)
Artikli sisukord
süstelahuse pulber ja lahusti (1000ühik)
Pakendi infoleht: teave kasutajale
FEIBA 500 Ü, süstelahuse pulber ja lahusti
FEIBA 1000 Ü, süstelahuse pulber ja lahusti
Faktor VIII inhibiitorist möödamineva aktiivsusega hüübimisfaktorid
Enne ravimi kasutamist lugege hoolikalt infolehte, sest siin on teile vajalikku teavet.
•Hoidke infoleht alles, et seda vajadusel uuesti lugeda.
•Kui teil on lisaküsimusi, pidage palun nõu oma arsti või apteekriga.
•Ravim on välja kirjutatud üksnes Teile. Ärge andke seda kellelegi teisele. Ravim võib olla neile kahjulik, isegi kui haigusnähud on sarnased.
•Kui teil tekib ükskõik milline kõrvaltoime, pidage nõu oma arsti või apteekriga. Kõrvaltoime võib olla ka selline, mida selles infolehes ei ole nimetatud. Vt lõik 4.
Infolehe sisukord:
1.Mis ravim on FEIBA ja milleks seda kasutatakse.
2.Mida on vaja teada enne FEIBA kasutamist.
3.Kuidas FEIBA`t kasutada.
4.Võimalikud kõrvaltoimed
5.Kuidas FEIBA`t säilitada
6.Pakendi sisu ja muu teave
1. Mis ravim on Feiba ja milleks seda kasutatakse
FEIBA on inimese plasmast valmistatud preparaat, mis aitab verel hüübida ka juhul kui inimese enda hüübimisfaktoreid on vähe või need puuduvad. FEIBA’t kasutatakse verehüübimishäirete raviks inhibiitoriga hemofiilia A või omandatud faktor VIII inhibiitorite korral.
2. Mida on vaja teada enne Feiba kasutamist
Rääkige oma arstile, kui teil on mistahes allergiaid.
Rääkige oma arstile, kui olete madala naatriumisisaldusega dieedil.
Ärge kasutage Feibat
Järgmistel juhtudel võite te FEIBA’t kasutada vaid juhul, kui ükski teine vere hüübimist soodustav ravi teid ei aita, sh kui teil on suur inhibiitori tiiter, eluohtlik hemorraagia (verejooks) või suurenenud veritsusrisk (sh trauma- või operatsioonijärgselt).
-kui olete FEIBA toimeaine või selle ravimi mis tahes koostisosa suhtes ülitundlik (allergiline).
-kui teil on dissemineeritud intravaskulaarne koagulatsioon (DIK, fibriinkaotussündroom, so üldine vere hüübimissüsteemi häire, mille korral hüübib veri soone siseselt ja põhjustab seeläbi hüübimisfaktorite defitsiidi, mis omakorda toob kaasa suurenenud riski verejooksudeks). Suurenenud risk DIK tekkeks on nendel patsientidel, kelle laboratoorsed analüüsid ja/või kliinilised sümptomid viitavad maksakahjustusele.
-kui teil on südamekoronaarhaigus, äge tromboos ja/või embolism: Feibat tuleb kasutada vaid eluohtlikes veritsusepisoodides.
Hoiatused ja ettevaatusabinõud
Enne Feiba kasutamist pidage nõu oma arstiga, sest sarnaselt teistele veenisiseselt manustatavatele plasmast toodetud ravimpreparaatidele võivad tekkida ülitundlikkusreaktsioonid . Et allergilist reaktsiooni ära tunda niipea kui võimalik, peate olema teadlik ülitundlikkusreaktsioonide võimalikest varajastest sümptomitest nagu:
-
Oerüteem (nahapunetus)
Onahalööve
Onõgeslööve (urtikaaria)
Osügelemine
Ohuulte ja keele turse
Ovilistav hingamine
Opigistustunne rinnus
Ohalb enesetunne
Opeapööritus
Ojärsk vererõhu langus
Muud ülitundlikkusreaktsioonide sümptomid plasmast toodetud ravimpreparaatide suhtes on letargia ja rahutus. Kui teil tekib mõni loetletud sümptomitest, katkestage infusioon koheselt ja pöörduge oma arsti poole. Loetletud sümptomid võivad viidata anafülaktilisele šokile. Rasked sümptomid nõuavad kiiret esmaabi.
Patsientidele, kellel kahtlustatakse ülitundlikkust toimeaine või mõne selle koostisosa suhtes, määrab arst
-kui teil tekivad suured muutused vererõhus või pulsikiiruses, hingamisraskus, köha või valu rinnas: katkestage infusioon koheselt ja pöörduge oma arsti poole. Teie arst algatab vajaliku uuringu ja ravi.
-inhibiitoritega hemofiiliaga või omandatud koagulatsioonifaktorite inhibiitoritega patsientidel võib ravi ajal Feibaga suureneda kalduvus veritsusele, samal ajal võib neil aga olla ka suurenenud tromboosirisk.
Ravi ajal
Et tegemist on inimverest või vereplasmast valmistatud tootega, siis on võetud kasutusele standardmeetmeid, et vältida infektsioonide ülekandumist patsientidele.
Need hõlmavad vere- ja plasmadoonorite hoolikat valikut, et esinevate nakkuste risk oleks välistatud ja individuaalsete vereannetuste ning kogutud plasma analüüsimine viiruste/ infektsioonide suhtes. Samuti on nende ravimpreparaatide tootjad lisanud vere ja plasma toomisprotsessi meetodeid, mis võivad viiruseid inaktiveerida/kõrvaldada. Vaatamata sellele, ei saa inimverest või plasmast valmistatud ravimpreparaatide puhul nakkustekitajate ülekandumise võimalust täielikult välistada. See kehtib ka mis tahes tundmatute või uute viiruste ja teiste patogeenide kohta.
Kasutatavaid meetmeid peetakse tõhusaks kapsliga viiruste nagu inimese immuunpuudulikkuse viiruse (HIV), B- hepatiidi viiruse ja
Regulaarselt/korduvalt inimplasmast toodetud fakor VIII ravimpreparaate saavate patsientide puhul tuleb kaaluda vastavat vaktsineerimist (hepatiit A ja B).
Tungivalt soovitatakse igakordsel Feiba manustamisel registreerida patsiendi nimi ja ravimpreparaadi partii number, et säiliks seos patsiendi ja ravimpreparaadi partii vahel.
Muud ravimid ja Feiba
Palun informeerige oma arsti, kui te kasutate või olete hiljuti kasutanud mingeid muid ravimeid, kaasa arvatud ilma retseptita ostetud ravimeid.
Feiba ja rekombinantse faktor VIIa või antifibrinolüütikumide kombineeritud või järjestikuse manustamise kohta ei ole ammendavaid ja hästi kontrollitud uuringuid tehtud.
Kasutades Feibaga ravimise ajal süsteemseid antifibrinolüütikume, nagu traneksaamhape ja aminokaproonhape, tuleb arvestada trombembooliliste sündmuste tekke võimalusega. Seepärast ei tohi antifibrinolüütikume kasutada umbes 6 kuni 12 tundi pärast Feiba manustamist.
Olemasolevate in vitro andmete ja kliiniliste tähelepanekute järgi, kui samal ajal kasutatakse rFVIIa, ei saa välistada võimalikku ravimite koostoimet, mis võib viia trombembooliliste sündmusteni.
Sarnaselt teiste vere hüübimisfaktoritega, ei tohi FEIBA’t enne manustamist teiste ravimitega või lahustitega segada, kuna see võib mõjutada ravimi efektiivsust ja ohutust. Enne ja pärast FEIBA infusiooni on soovitatav venoosset juurdepääsu isotoonilise füsioloogilise lahusega loputada.
Fertiilsus, rasedus ja imetamine
Enne ravimi kasutamist pidage nõu oma arsti või apteekriga.
Teie arst otsustab, kas te võite FEIBA’t raseduse ja imetamise ajal kasutada. Kuna raseduse ajal suureneb tromboosi tekke risk, tuleb FEIBA’t manustada ainult hoolika meditsiinilise järelvalve all ja äärmisel vajadusel.
Autojuhtimine ja masinatega töötamine
Ei ole teada, et FEIBA mõjutaks autojuhtimise ja masinate käsitsemise võimet.
Feiba sisaldab naatriumi
FEIBA (500 Ü ja 1000 Ü) sisaldab ligikaudu 80 mg naatriumit (arvutuslik) viaali kohta. Seda peab võtma arvesse madala naatriumisisaldusega dieedil olevate patsientide ravimisel.
3. Kuidas Feibat kasutada
Valmistage külmkuivatatud FEIBA pulbrist ja kaasasolevast süsteveest lahus ning manustage see veenisiseselt.
Kasutage FEIBA’t alati nii nagu arst on teile rääkinud. Kui te ei ole milleski kindel, pidage nõu oma arsti või apteekriga.
Teie arst on määranud annuse ja manustamisintervallid isiklikult teile, arvestades vere hüübimishäire raskust, veritsuse asukohta ja ulatust, teie üldseisundit ning reaktsiooni

preparaadile. Ärge muutke arsti poolt määratud annust ning ärge katkestage ise ravimi kasutamist.
Pöörduge oma arsti või apteekri poole kui tunnete, et FEIBA toime on liiga tugev või liiga nõrk.
Enne manustamist soojendage ravim vajaduse korral toa- või kehatemperatuurini. FEIBA lahus tuleb valmistada vahetult enne manustamist. Lahus tuleb seejärel koheselt kasutada (preparaat ei sisalda säilitusaineid).
Keerake õrnalt, kuni kogu pulber on lahustunud. Veenduge, et FEIBA on täielikult lahustunud; vastasel juhul pääseb vähem FEIBA ühikuid läbi seadme filtri.
Hägused või osakesi sisaldavad lahused tuleb nõuetekohaselt hävitada.
Ärge kasutage avatud pakendeid uuesti. Lahuse valmistamiseks kasutage ainult pakis olevat lahustit (steriilset süstevett) ja vahendeid.
Kui Feiba manustamiseks kasutatakse muid vahendeid, tuleb veenduda, et kasutataval seadmel olev filter on piisava poorisuurusega, st vähemalt 149 µm.
Ärge kasutage toodet, mille steriilsus või pakend on kahjustatud või kui on muid märke, et toode on kasutamiseks kõlbmatu.
Registreerige preparaadi manustamine kaasasoleval iseliimuval etiketil. Hävitage ravimijääk ja jäätmed nõuetekohaselt.
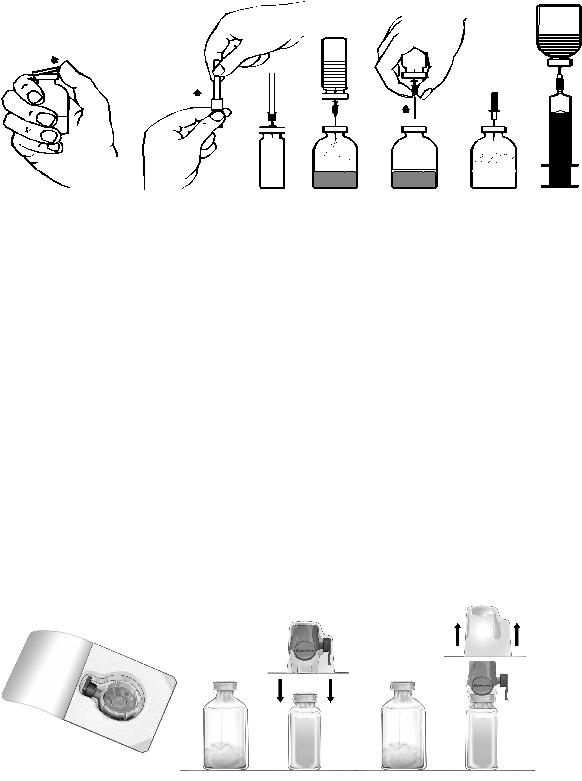
Süstelahuse valmistamine ülekandenõela abil
Kogu protseduuri vältel tuleb kasutada aseptilist tehnikat.
1.Vajaduse korral soojendage avamata lahustiviaal (steriliseeritud süstevesi) toatemperatuurini, näit. kasutades mõne minuti vältel steriilset veevanni (maksimaalselt +37 °C).
2.Eemaldage kontsentraadi- ja lahustipudelitelt kaitsekaaned (Joon. A) ja desinfitseerige mõlema pudeli kummikorgid.
3.Eemaldage kaitsekate kaasasoleva ülekandenõela ühelt otsalt seda pöörates ja tõmmates (Joon. B). Viige paljastatud nõel läbi lahusti viaali kummikorgi (Joon. C).
4.Eemaldage kaitsekate ülekandenõela teisest otsast, puudutamata selle katmata otsa.
5.Pöörake lahusti viaal kontsentraadi viaali kohale ja viige ülekandenõela vaba ots läbi kontsentraadi viaali kummikorgi (Joon. D). Tõmmatakse lahusti vaakumi abil kontsentraadi viaali.
6.Eraldage viaalid teineteisest, eemaldades nõela kontsentraadi viaalist (Joon. E). Lahustumise kiirendamiseks loksutage või keerutage kontsentraadi viaali ettevaatlikult.
7.Pärast kontsentraadi täielikku lahustumist tuleb vahu eemaldamiseks torgata viaali kaasasolev õhutusnõel (Joon. F). Tõmmake õhutusnõel välja.
Injektsioon/infusioon:
Kogu protseduuri vältel tuleb kasutada aseptilist tehnikat.
1.Eemaldage kaitsekate kaasasolevalt filternõelalt, seda keerates ja tõmmates, ning sobitage nõel steriilsele ühekordseks kasutamiseks mõeldud süstlale. Tõmmake lahus süstlasse (Joon. G).
2.Eemaldage süstlalt filternõel ja süstige lahus aeglaselt veeni kaasasoleva tiivakestega infusioonikomplekti abil (või kaasasoleva ühekordse nõelaga).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Joon.A |
Joon.B |
|
Joon.C Joon.D |
Joon.E |
|
|
Joon.F |
|
|
|
||||||
Joon.G |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Süstelahuse valmistamine BAXJECT II
1.Vajaduse korral soojendage avamata lahustipudel (steriliseeritud süstevesi) toatemperatuurini, näit. kasutades mõne minuti vältel steriilset veevanni (maksimaalselt +37 °C).
2.Eemaldage kontsentraadi- ja lahustipudelitelt kaitsekaaned ja desinfitseerige mõlema pudeli kummikorgid. Asetage pudelid tasasele pinnale.
3.Avage BAXJECT’i pakend, rebides sellelt paberkatte. Ärge puudutage pakendi sisemust (Joon. A). Ärge võtke BAXJECT’i pakendist välja.
4.Pöörake pakend ümber ja torgake plastteravik läbi lahusti korgi (Joon. B). Võtke pakendi servadest kinni ja tõmmake see BAXJECT’i pealt ära (Joon. C).
Ärge võtke sinist korki BAXJECT’i küljest lahti.
5.Pöörake lahustipudel ja selles kinniolev BAXJECT’i süsteem kontsentraadi viaali kohale ja torgake teine plastteravik läbi kontsentraadipudeli kummikorgi. Vaakumi tõttu voolab lahusti kontsentraadipudelisse (Joon. D).
6.Segage kergelt, mitte raputada, kuni kogu pulber on lahustunud. FEIBA peab olema täielikult lahustunud, et toimeaine saaks läbida süsteemi filtrit.
Joon.A |
Joon.B |
Joon.C |
Manustamine:
Kogu protseduuri vältel tuleb kasutada aseptilist tehnikat.
1.Eemaldage BAXJECT’lt sinine kork. Ühendage süstal tihedalt BAXJECT’i otsikuga. MITTE TÕMMATA ÕHKU SÜSTLASSE. (Joon. E). Veedumaks, et süstal on tihedalt ühendatud BAXJECT’iga, on soovitatav kasutada luer kinnitusega süstalt (keerata süstalt kellaosuti suunas kuni
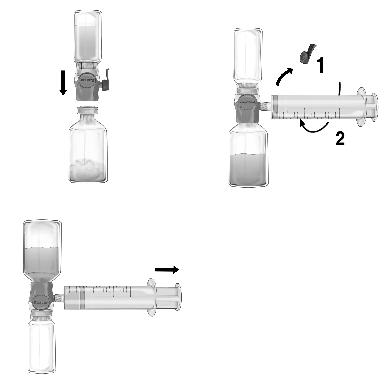
2.Pöörake süsteem ümber nii, et lahustunud FEIBA viaal jääb ülespoole. Tõmmake lahus süstlasse (Joon. F) kolbi aeglaselt tagasi tõmmates ja veenduda, et kogu selle protseduuri ajal oleks süstal tihedalt ühendatud BAXJECT’iga (Joonis F).
3.Eemaldage süstal Baxject’i otsikust.
4.Kui süstlas on näha vahtu, oodata kuni selle kadumiseni. Süstige lahus aeglaselt veeni kaasasoleva tiivakestega infusioonikomplekti (või nõela) abil.
Joon.D |
Joon.E |
Joon.F |
Ei tohi ületada süste/infusioonikiirust 2 Ü/kg/min.
Kui te manustate FEIBA’t rohkem kui ette nähtud
Teavitage sellest koheselt arsti. FEIBA üleannustamine võib suurendada kõrvaltoimete riski nagu trombembolism (verehüüvete teke, mis uhutakse vereringesse), fibriinkaotussündroom (DIK) või südameinfarkt.
4. Võimalikud kõrvaltoimed
Nagu kõik ravimid, võib ka see ravim põhjustada kõrvaltoimeid, kuigi kõigil neid ei teki. Kui ükskõik milline kõrvaltoimetest muutub tõsiseks või kui te märkate mõnda kõrvaltoimet, mida selles infolehes ei ole nimetatud, palun rääkige sellest oma arstile või apteekrile.
Kõrvaltoimete esinemissagedus on määratletud vastavalt:
väga sage |
võib esineda rohkem kui 1 inimesel 10st |
sage |
võib esineda kuni 1 inimesel 10st |
võib esineda kuni 1 inimesel 100st |
|
harv |
võib esineda kuni 1 inimesel 1000st |
väga harv |
võib esineda kuni 1 inimesel 10000st |
teadmata |
ei saa hinnata olemasolevate andmete alusel |
Allpool toodud kõrvaltoimetest on teatatud kliiniliste uuringute käigus sagedusega sage:
Ülitundlikkus,
Peavalu,
Pearinglus,
Hüpotensioon
Lööve
Allpool toodud kõrvaltoimetest on teatatud turuletulekujärgselt sagedusega teadmata:
Vere ja lümfisüsteemi häired: dissemineeritud intravaskulaarne koagulatsioon (DIK), inhibiitori tiitri suurenemine
Immuunsüsteemi häired: allergilised reaktsioonid, nõgeslööve üle keha (urtikaaria). Närvisüsteemi häired: jäsemete tundetus (hüpoesteesia), ebanormaalsed või vähenenud aistingud (paresteesia), insult (trombootiline, embooliline insult), unisus (somnolentsus), maitsetundlikkuse muutus (düsgeusia)
Südame häired: südameinfarkt, südamepekslemine (tahhükardia)
Vaskulaarsed häired: trombide moodustumine ja vereringesse sattumine (trombemboolilised sündmused), vererõhu langus (hüpotensioon), nahapunetus
Respiratoorsed, rindkere ja mediastiinumi häired: kopsuarteri obstruktsioon (kopsuemboolia), õhuteede konstriktsioon (bronhospasm), hingeldus, köha, hingamisraskused (düspnoe)
Seedetrakti häired: oksendamine, kõhulahtisus, ebamugavustunne kõhus, halb enesetunne (iiveldus)
Naha ja nahaaluskoe kahjustused: näo tundetus, näo, keele ja huulte turse (angioödeem), kogu keha nõgeslööve (urtikaaria), sügelus (pruritus),
Üldised häired ja manustamiskoha reaktsioonid: valu süstekohal, üldine ebamugavustunne, kuumatunne, külmavärinad, palavik, valu rindkeres, ebamugavustunne rindkeres
Uuringud: vererõhu langus
Kiire intravenoosne süst või infusioon võib tekitada valu, näo ja jäsemete tundetust ning vererõhu langust.
FEIBA ööpäevase maksimaalse annuse ületamisel ja/või pikaajalisel manustamisel ning trombembolismi riskiga patsientidel on Feiba manustamise järgselt esinenud infarkti.
Kõrvaltoimetest teavitamine
Kui teil tekib ükskõik milline kõrvaltoime, pidage nõu oma arsti, apteekri või meditsiiniõega. Kõrvaltoime võib olla ka selline, mida selles infolehes ei ole nimetatud. Kõrvaltoimetest võite ka ise teavitada www.ravimiamet.ee kaudu. Teavitades aitate saada rohkem infot ravimi ohutusest.
5. Kuidas Feibat säilitada
Hoidke seda ravimit laste eest varjatud ja kättesaamatus kohas.
Hoida temperatuuril kuni 25°C. Mitte lasta külmuda.
Hoida originaalpakendis, valguse eest kaitstuna.
Mitte kasutada pärast pakendile ja etiketile märgitud kõlblikkusaja lõppu. Kõlblikkusaeg viitab kuu viimasele päevale.
Ravimeid ei tohi ära visata kanalisatsiooni kaudu ega koos majapidamisprügiga. Küsige oma apteekrilt, kuidas hävitatakse ravimeid, mida enam ei vajata. Need meetmed aitavad kaitsta keskkonda.
6. Pakendi sisu ja muu teave
Mida Feiba sisaldab
-Toimeaine on faktor VIII inhibiitorist möödamineva aktiivsusega hüübimisfaktorid
-Abiained on naatriumkloriid ja naatriumtsitraat.
Pulber
Feiba 500 Ü - toimeaine sisaldus kummikorgiga viaalis on 500 Ü faktor VIII inhibiitorist möödamineva aktiivsusega hüübimisfaktoreid mis sisaldub 200...600 mg inimese plasma proteiinis.
Feiba 1000 Ü - toimeaine sisaldus ühes viaalis on 1000 Ü faktor VIII inhibiitorist möödamineva aktiivsusega hüübimisfaktoreid mis sisaldub 400...1200 mg inimese plasma proteiinis.
FEIBA sisaldab ka faktoreid II; IX ja X peamiselt mitteaktiveeritud kujul nagu ka aktiveeritud faktor VII. Faktor VIII koagulentset antigeeni (F VIII C: Ag) ja
Lahusti
Steriliseeritud süstevesi
Kuidas Feiba välja näeb ja pakendi sisu
Valge, valkjas või kahvatu roheline külmkuivatatud pulber või murenev tahke mass. Süstelahuse pulber ja lahusti on kummikorgiga suletud klaasist viaalides.
Värskelt valmistatud lahuse pH väärtus on vahemikus 6,8...7,6.
Pakendi suurus: 1 ühik
Ülekandenõelaga pakendis on:
1 kummikorgi ja kaitsekaanega viaal FEIBA 500/1000 Ü – süstelahuse pulber 1 kummikorgi ja kaitsekaanega viaal 20 ml steriliseeritud süstevesi
süstal
nõel
ülekandenõel
õhustamisnõel
klambriga libliknõel
BAXJECT
1 kummikorgi ja kaitsekaanega viaal FEIBA 500/1000 Ü – süstelahuse pulber 1 kummikorgi ja kaitsekaanega viaal 20 ml steriliseeritud süstevesi
1 BAXJECT
süstal
nõel
klambriga libliknõel
Müügiloa hoidja ja tootja
Müügiloa hoidja
Baxalta Innovations GmbH
Industriestrasse 67
Austria
Tootja
Baxter AG
Industriestrasse 67
Austria
Infoleht on viimati kooskõlastatud augustis 2016.
___________________________________________________________________________
___
JÄRGMINE TEAVE ON AINULT TERVISHOIUTÖÖTAJATELE:
Ravi peab olema algatatud ja läbi viidud hemofiilia ravis kogenud arsti järelvalve all.
Annustamine
Annus ja ravi kestvus sõltuvad hemostaasihäire ulatusest, veritsuse asukohast ja ulatusest ning patsiendi kliinilisest seisundist.
Annus ja manustamise sagedus tuleb määrata vastavalt kliinilisele efektiivsusele iga patsiendi puhul individuaalselt.
Üldjuhul on soovitatav annus 50...100 Ü FEIBA`t kehakaalu kilogrammi kohta. Maksimaalne ühekordnet annus on 100 Ü/ kg ja maksimaalne ööpäevane annus on 200 Ü/ kg, välja arvatud juhul, kui verejooksu raskus nõuab ja õigustab suuremate annuste kasutamist.
Patsiendist sõltuvate tegurite tõttu võib ravivastus koagulatsiooniravimile olla erinev. Verejooksuga patsientidel, kellel tekib puudulik vastus ühele ravimile, võib tekkida ravivastus teisele ravimile. Kui esineb puudulik vastus ühele koagulatsiooniravimile, tuleb kaaluda teise ravimi kasutamist.
Lapsed
Kogemused alla
1) Spontaanne veritsus.
Liigese, lihase või pehme koe hemorraagia. Vähese või mõõduka veritsuse puhul on soovitatav annus 50…75 Ü/kg
Lihase ja pehme koe suurema hemorraagia korral nagu retroperitoneaalne veritsus, soovitatakse annust 100 Ü/kg
Limaskestade veritsus. Soovitatakse annust 50 Ü/kg manustatuna
mõõtmised). Kui hemorraagia ei lakka, võib annust suurendada kuni 100 Ü/kg, kuid maksimaalset ööpäevast annust 200 Ü/kg ei tohi ületada.
Teised ägedad veritsused. Ägeda hemorraagia, nagu kesknärvisüsteemi veritsus, raviks on soovitatav annus 100 Ü/kg manustatuna 12
2) Kirurgia
Soovitatavaks annuseks on 50…100 Ü/kg kuni
3) Profülaktika
Kõrge inhibiitori tiitriga ja sagedaste veritsustega patsientide puhul võib FEIBA’t kasutada ka veritsuste profülaktikaks:
•Kasutamisel samaaegselt immunteraapiaga on Feiba soovituslikeks profülaktiliseks annuseks
•Patsientidele, kes pole immuunteraapiast abi saanud või kellele see ei sobi, soovitatakse veritsuste profülaktikaks annuseid vahemikus
* 1 Bethesda ühik vastab antikehade kogusele, mis inhibeerib 37O C juures 2 tunni jooksul inkubeeritult 50% värske keskmise inimplasma FVIII aktiivsusest.
Jälgimine
Keeruka toimemehhanismi tõttu ei ole toimeaine otsene jälgimine võimalik. Koagulatsioonitestid, nagu täisvere hüübimisaeg (WBCT), tromboelastogramm (TEG, r- väärtus) ja aPTT näitavad tavaliselt ainult kerget lühenemist ega korreleeru tingimata kliinilise tõhususega. Seetõttu on nendel testidel vaid väike tähtsus ravi jälgimises
Manustamine
FEIBA tuleb manustada aeglaselt, (mitte ületada süstimis/infusioonikiirust 2 Ü/kg/min) intravenoosselt.
FEIBA lahus tuleb valmistada vahetult enne manustamist, st koheselt kasutada (preparaat ei sisalda säilitusaineid). Kui lahus on hägune või sisaldab osakesi, siis ei tohi seda kasutada, vaid see tuleb nõuetekohaselt hävitada.
Ravi jälgimine
FEIBA maksimaalset ühekordset annust 100 Ü/kg ja maksimaalset ööpäevast annust 200 Ü/kg ei tohi ületada.
Patsiente, kellele on manustatud FEIBA’t rohkem kui 100 Ü/kg, tuleks jälgida DIK`i arengu ja/või ägeda koronaarisheemia sümptomite suhtes.
FEIBA suuri annuseid tuleks manustada ainult nii kaua, kuni see on verejooksu peatamiseks hädavajalik.
Juhul kui tekivad muutused patsiendi vererõhus, pulsi sageduses, hingamishäired, valu rindkeres või köha, tuleb infusioon kohe lõpetada ning alustada diagnostiliste- ja ravivõtetega. DIK`ile iseloomulikud tunnused laborianalüüsides on järgmised: vähenenud fibrinogeen, vähenenud trombotsüütide arv, ja/või vähenenud fibriini/fibrinogeeni degradatsiooniproduktid (FDP), samuti oluliselt pikenenud trombiiniaeg, protrombiiniaeg või APTT.
Inhibiitoritega hemofiilia patsientide ja faktorite VIII, XI või XII vastu omandatud inhibiitoritega patsientide aPTT on varjatud haiguse tõttu pikenenud.
FEIBA (500 Ü ja 1000 Ü) sisaldab ligikaudu 80 mg naatriumit (arvutuslik) viaali kohta. Seda peab võtma arvesse madala naatriumisisaldusega dieedil olevate patsientide ravimisel.
FEIBA manustamine patsientidele, kes saavad inhibiitoreid, võib põhjustada esialgse anamnestilise inhibiitorite taseme tõusu. FEIBA jätkuval manustamisel võivad inhibiitorid aja jooksul väheneda. Kliinilised ja avaldatud andmed näitavad, et FEIBA tõhusus ei vähene.
Inhibiitoritega hemofiilia patsientidel ning omandatud koagulatsioonifaktorite inhibiitoritega patsientidel võib ravi ajal FEIBA’ga tekkida kalduvus veritsusele, samal ajal võib neil aga olla ka suurenenud tromboosirisk.
Laboratoorsed testid ja kliiniline efektiivsus
In Vitro testid nagu APTT, vere hüübimisaeg ja tromboelastogramm (TEG) ei sobi FEIBA ravi efektiivsuse jälgimiseks, kuna nende tulemused ei korreleeru patsiendi kliinilise paranemisega. Seetõttu ei peaks Feiba annust suurendama, kui nende analüüside tulemused ei ole paranenud, kuna sel juhul tekib oht FEIBA üleannustamiseks, millega võib kaasuda DIK.
Juhul kui ei teki oodatud ravivastust Feiba`le, tuleks määrata trombotsüütide arvu, sest selleks, et Feiba saaks toimida, on vaja, et patsiendi funktsionaalselt intaksete trombotsüütide arv veres oleks piisavalt kõrge.

Lisainfo BAXJECT II
-süsteem on steriliseeritud gamma kiirgusega.
-süsteem on ühekordseks kasutamiseks.
-süsteem on lateksivaba.
Mitte kasutada kui pakend on kahjustatud
Baxter Healthcare SA, 8010 Zurich, Šveits
BAXTER, FEIBA ja BAXJECT on Baxter International Inc ja Baxter Healthcare SA. registreeritud kaubamärk
RAVIMI OMADUSTE KOKKUVÕTE
1.RAVIMPREPARAADI NIMETUS
Feiba 500 Ü, süstelahuse pulber ja lahusti
Feiba 1000 Ü, süstelahuse pulber ja lahusti
2.KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS
Toimeaine: faktor VIII inhibiitorist möödamineva aktiivsusega hüübimisfaktorid
Feiba 500 Ü:1 ml Feibat sisaldab 25Ü aktiivset toimeainet. Igas Feiba 500 Ü* viaalis on 500 Ü faktor VIII inhibiitorist möödamineva aktiivsusega hüübimisfaktoreid ja 200 kuni 600 mg inimvere plasma proteiini.
Feiba 1000 Ü: 1 ml Feibat sisaldab 50 Ü aktiivset toimeainet. Igas Feiba 1000 Ü* viaalis on 1000 Ü faktor VIII inhibiitorist möödamineva aktiivsusega hüübimisfaktoreid ja 400 kuni 1200 mg inimvere plasma proteiini.
Feiba sisaldab ka faktoreid II; IX ja X peamiselt mitteaktiveeritud kujul nagu ka aktiveeritud faktor VII; faktor VIII koagulentset antigeeni (F VIII C: Ag) on kontsentratsioonis kuni 0,1 Ü ühe Feiba ühiku kohta.
Preparaat sisaldab ainult jälgedena; kui üldse,
* 1 Ü Feiba’t lühendab kõrge faktor VIII inhibiitori sisaldusega plasma aktiveeritud partsiaalset tromboplastiiniaega (APTT) 50% võrra võrreldes puhverväärtusega (tühiväärtus).
Abiainete täielik loetelu vt lõik 6.1.
3.RAVIMVORM
Süstelahuse pulber ja lahusti.
Valge, valkjas või kahvatu roheline külmkuivatatud pulber või murenev tahke mass. Värskelt valmistatud lahuse pH väärtus on vahemikus 6,8 ...7,6.
4. KLIINILISED ANDMED
4.1 Näidustused
Verehüübimishäired inhibiitoriga hemofiilia A või omandatud faktor VIII inhibiitori korral.
4.2 Annustamine ja manustamisviis
Ravi peab olema algatatud ja läbi viidud hemofiilia ravis kogenud arsti järelvalve all.
4.2.1 Annustamine
Annus ja ravi kestus sõltuvad hemostaasihäire ulatusest, veritsuse asukohast ja ulatusest ning patsiendi kliinilisest seisundist.
Annus ja manustamise sagedus tuleb määrata vastavalt kliinilisele efektiivsusele iga patsiendi puhul individuaalselt.
Üldjuhul on soovitatav annus 50...100 Ü Feibat kehakaalu kilogrammi kohta. Maksimaalne ühekordne annus on 100 Ü/kg ja maksimaalne ööpäevane annus 200 Ü/kg, neid annuseid ei tohi ületada, välja arvatud juhul, kui verejooksu raskus nõuab ja õigustab suuremate annuste kasutamist. Vt lõik 4.4.
Lapsed
Kogemused alla
1) Spontaanne veritsus.
Liigese, lihase või pehme koe hemorraagia.
Vähese või mõõduka veritsuse puhul on soovitatav annus 50…75 Ü/kg
Lihase ja pehme koe suurema hemorraagia korral nagu retroperitoneaalne veritsus, soovitatakse annust 100 Ü/kg
Limaskestade veritsus.
Soovitatakse annust 50 Ü/kg manustatuna
Teised rasked veritsused.
Raske hemorraagia, nagu kesknärvisüsteemi veritsus, raviks on soovitatav annus 100 Ü/kg manustatuna
2) Kirurgia
Soovitatavaks annuseks on 50…100 Ü/kg kuni
3) Profülaktika
Kõrge inhibiitori tiitriga ja sagedaste veritsustega patsientide puhul võib Feiba’t kasutada ka veritsuste profülaktikaks:
•Kasutamisel samaaegselt immunteraapiaga on Feiba soovituslikeks profülaktiliseks annuseks
•Patsientidele, kes pole immuunteraapiast abi saanud või kellele see ei sobi, soovitatakse veritsuste profülaktikaks annuseid vahemikus
* 1 Bethesda ühik vastab antikehade kogusele, mis inhibeerib 37O C juures 2 tunni jooksul inkubeeritult 50% värske keskmise inimplasma FVIII aktiivsusest.
4.2.2 Jälgimine
Juhul kui ei teki oodatud ravivastust Feiba`le, tuleks määrata trombotsüütide arvu, sest selleks, et Feiba saaks toimida, on vaja, et patsiendi funktsionaalselt intaksete trombotsüütide arv veres oleks piisavalt kõrge.
Keeruka toimemehhanismi tõttu ei ole toimeainete otsene jälgimine võimalik. Koagulatsioonitestid, nagu täisvere hüübimisaeg (WBCT), tromboelastogramm (TEG,
4.2.3 Manustamisviis
Feibat tuleb manustada intravenoosse süste või infusioonina. Manustamiskiirus peab olema patsiendi jaoks mugav ega tohi ületada maksimaalset kiirust 2 Ü/kg minutis.
4.3 Vastunäidustused
Feiba’t ei tohi kasutada järgmistel juhtudel, kui alternatiivsed ravivõimalused on kättesaadavad:
-Ülitundlikkus toimeaine või ravimi ükskõik millise koostisosa suhtes, loetletud lõigus 6.1.
-Dissemineeritud intravaskulaarne koagulatsioon (DIK)
-Äge tromboos või emboolia (sh müokardiinfarkt)
Vaata lõik 4.4.
4.4 Erihoiatused ja ettevaatusabinõud kasutamisel
HOIATUSED
Trombemboolilised sündmused
Ravi ajal
Mõned nendest sündmustest esinesid suuremate annuste kasutamisel kui 200 Ü/kg ööpäevas või teiste trombembooliliste sündmuste riskiteguritega (sh DIK, kaugelearenenud aterosklerootiline haigus, muljumistrauma, septitseemia) patsientidel. Samaaegselt rekombinantse faktor
Feibat tuleb erilise ettevaatusega kasutada
Trombembooliliste sündmuste esimeste sümptomite või tunnuste ilmnemisel tuleb infusioon viivitamatult katkestada ning alustada asjakohaste diagnostiliste ja terapeutiliste võtetega.
Feiba 100 Ü/kg ühekordset annust ja 200 Ü/kg ööpäevast annust ei tohi ületada, välja arvatud juhtudel, mil verejooksu raskus nõuab ja õigustab suuremate annuste kasutamist. Verejooksu peatamiseks tuleb Feibat manustada ainult nii kaua, kui see on ravieesmärgi saavutamiseks hädavajalik.
Allergilist tüüpi ülitundlikkusreaktsioonid
Feiba võib esile kutsuda allergilist tüüpi ülitundlikkusreaktsioone, mille hulgas on esinenud urtikaariat, angioödeemi, seedetrakti nähtusid, bronhospasmi ja hüpotensiooni; need reaktsioonid võivad olla tugevad ja süsteemsed (nt anafülaksia koos urtikaaria ja
angioödeemiga, bronhospasm ning tsirkulatoorne šokk). Teatatud on ka muudest infusioonireaktsioonidest, näiteks külmavärinatest, püreksiast ja hüpertensioonist.
Infusiooni/ülitundlikkusreaktsiooni esimeste märkide ilmnemisel tuleb Feiba manustamine katkestada ja alustada kohast ravi.
FEIBA taasmanustamise kaalumisel ravimi või mõne selle koostisosa suhtes teadaoleva või kahtlustatava ülitundlikkusega patsientidele tuleb põhjalikult kaaluda taasmanustamisest oodatavat kasu ja riski, arvestades patsiendi teadaoleva või kahtlustatava ülitundlikkuse tüüpi (allergiline või mitteallergiline), sealhulgas võimalikku ravi ja/või ennetavaid vahendeid või alternatiivseid ravimeid.
Ravi jälgimine
Feiba maksimaalsed lubatud annused on 100 Ü/kg ühekordsel manustamisel ja 200 Ü/kg ööpäevas. Patsiente, kellele manustatakse Feibat rohkem kui 100 Ü/kg, tuleb hoolikalt jälgida DIKi arengu ja/või ägeda koronaarisheemia sümptomite suhtes. Feiba suuri annuseid tuleks manustada ainult nii kaua, kui see on verejooksu peatamiseks hädavajalik.
Juhul kui tekivad kliiniliselt olulised muutused patsiendi vererõhus, pulsi sageduses, hingamishäired, valu rindkeres või köha, tuleb infusioon kohe lõpetada ning alustada kohaste diagnostiliste- ja ravivõtetega.
DIKile iseloomulikud tunnused laborianalüüsides on järgmised: vähenenud fibrinogeen, vähenenud trombotsüütide arv ja/või vähenenud fibriini/fibrinogeeni degradatsiooniproduktid (FDP).
Omandatud hemofiilia
Inhibiitoritega hemofiiliaga või omandatud koagulatsioonifaktorite inhibiitoritega patsientidel võib ravi ajal Feibaga suureneda kalduvus veritsusele, samal ajal võib neil aga olla ka suurenenud tromboosirisk.
Laboratoorsed testid ja kliiniline efektiivsus
In vitro testid nagu APTT, täisvere hüübimisaeg ja tromboelastogramm (TEG) ei sobi Feiba ravi efektiivsuse jälgimiseks, kuna nende tulemused ei pruugi korreleeruda kliinilise pildiga. Seetõttu ei peaks Feiba annust suurendama, kui nende analüüside tulemused ei ole paranenud, kuna sel juhul tekib oht Feiba üleannustamiseks, millega võib omakorda kaasuda DIK.
Trombotsüütide arvu tähtsus
Juhul kui ei teki oodatud ravivastust Feiba`le, tuleks määrata trombotsüütide arvu, sest selleks, et Feiba saaks toimida, on vaja, et patsiendi funktsionaalselt intaksete trombotsüütide arv veres oleks piisavalt kõrge.
Nakkuste ülekandumise ennetamise meetmed
Inimverest või vereplasmast valmistatud ravimpreparaatide kasutamisega seotud infektsioonide ennetamise standardmeetmed on doonorite valik, individuaalsete vereannetuste ja kogutud plasma sõelumine infektsioonimarkerite suhtes ja efektiivsete tootmismeetodite kasutamine viiruste inaktiveerimiseks/kõrvaldamiseks.
Vaatamata sellele, ei saa inimverest või plasmast valmistatud ravimpreparaatide puhul nakkustekitajate ülekandumise võimalust täielikult välistada. See kehtib ka mis tahes tundmatute või uute viiruste ja teiste patogeenide kohta.
Kasutatavaid meetmeid peetakse tõhusaks kapsliga viiruste nagu inimese immuunpuudulikkuse viiruse (HIV), B- hepatiidi viiruse (HBV) ja
Tungivalt soovitatakse igakordsel Feiba manustamisel patsiendile registreerida nimi ja ravimpreparaadi partii number, et säiliks seos patsiendi ja ravimpreparaadi partii vahel. Regulaarselt/korduvalt inimplasmast toodetud ravimpreparaate, sealhulgas Feibat saavate patsientide puhul tuleb kaaluda vastavat vaktsineerimist (hepatiit A ja B).
ETTEVAATUSABINÕUD
Trombemboolilised tüsistused
Järgnevates olukordades võib Feibat kasutada ainult juhul, kui on alust arvata, et ravi sobiva koagulatsioonifaktori kontsentraadiga ei anna tulemust, nt juhul, kui on inhibiitori suur tiiter, eluohtlik hemorraagia või veritsusrisk (nt trauma- või operatsioonijärgne):
-Dissemineeritud intravaskulaarne koagulatsioon (DIK) – vt lõik 4.3
-Maksakahjustus:
aktiveeritud koagulatsioonifaktorite hilinenud kliirensi tõttu on maksatalitluse häirega patsientidel suurenenud
-Südame koronaarhaigus, äge tromboos ja/või emboolia – vt lõik 4.3
Puudulik ravivastus koagulatsiooniravimile
Patsiendist sõltuvate tegurite tõttu võib ravivastus koagulatsiooniravimile olla erinev. Verejooksuga patsientidel, kellel tekib puudulik vastus ühele ravimile, võib tekkida ravivastus teisele ravimile.
Kui esineb puudulik vastus ühele koagulatsiooniravimile, tuleb kaaluda teise ravimi kasutamist.
Anamnestilised reaktsioonid
FEIBA manustamine inhibiitoritega patsientidele võib põhjustada esialgse anamnestilise inhibiitorite sisalduse suurenemise. FEIBA jätkuval manustamisel võivad inhibiitorid aja jooksul väheneda. Kliinilised ja avaldatud andmed näitavad, et FEIBA tõhusus ei vähene.
Passiivselt ülekantud
Lapsed
Juhtumite aruanded ja piiratud kliiniliste uuringute andmed viitavad, et Feibat saab kasutada alla
Profülaktiline kasutamine
Kliinilised andmed FEIBA kasutamise kohta veritsuse ennetamiseks hemofiiliaga patsientidel on piiratud.
Abiainetega seotud kaalutlused
Pakend suurusega 500 Ü ja 1000 Ü sisaldab ligikaudu 80 mg naatriumit (arvutuslik) viaali kohta. Seda peab võtma arvesse väikese naatriumisisaldusega dieedil olevate patsientide ravimisel.
4.5 Koostoimed teiste ravimitega ja muud koostoimed
Feiba ja rekombinantse faktor VIIa või antifibrinolüütikumide kombineeritud või järjestikuse manustamise kohta ei ole ammendavaid ja hästi kontrollitud uuringuid tehtud.
Kasutades Feibaga ravimise ajal süsteemseid antifibrinolüütikume, nagu traneksaamhape ja aminokaproonhape, tuleb arvestada trombembooliliste sündmuste tekke võimalusega.
Seepärast ei tohi antifibrinolüütikume kasutada umbes 6 kuni 12 tundi pärast Feiba manustamist.
Olemasolevate in vitro andmete ja kliiniliste tähelepanekute järgi võib juhtudel, kui samal ajal kasutatakse rFVIIa, tekkida võimalik ravimite koostoime (mis võib põhjustada soovimatuid toimeid, nagu trombemboolilised sündmused).
4.6 Fertiilsus, rasedus ja imetamine
Puuduvad piisavad andmed FEIBA kasutamise kohta raseduse ja imetamise ajal.
Arstid peavad iga patsiendi puhul enne FEIBA väljakirjutamist hoolikalt kaaluma võimalikke riske ja saadavat kasu.
Rasedust ja sünnitusjärgset perioodi iseloomustab suurenenud tromboosirisk ja mitmed raseduse tüsistused on seotud suurenenud
Vt teavet parvoviirus B19 nakkuse kohta lõik 4.4.
4.7 Toime reaktsioonikiirusele
Ei ole tõendeid, et preparaat mõjustaks autojuhtimist või masinate käsitsemise võimet.
4.8 Kõrvaltoimed
Selles lõigus loetletud kõrvaltoimed on registreeritud turustamisjärgse järelevalve käigus, samuti kahes uuringus, kus Feibaga raviti A- või
Sageduskategooriad on määratletud vastavalt järgmisele konventsioonile:
väga sage |
≥ 1/10 |
sage |
≥ 1/100 kuni < 1/10 |
≥ 1/1000 kuni < 1/100 |
|
harv |
≥ 1/10 000 kuni <1/1000 |
väga harv |
< 1/10 000 |
teadmata |
ei saa hinnata olemasolevate andmete alusel |
|
|
|||||
|
|
|
|
|
|
|
||
|
Organsüsteemi klass |
MedDra |
(versioon |
18.0) |
Sageduskategooria |
|||
|
|
|
eelistermin |
|
|
|
|
|
|
Vere |
ja lümfisüsteemi |
Dissemineeritud |
intravaskulaarne |
Teadmata |
|||
|
häired |
|
koagulatsioon (DIK) |
|
|
|||
|
|
|
Inhibiitori |
tiitri |
suurenemine |
Teadmata |
||
|
|
|
(anamnestiline reaktsioon)A |
|
|
|||
|
Immuunsüsteemi häired |
ÜlitundlikkusC Urtikaaria |
|
Sage |
||||
|
|
|
Anafülaktiline reaktsioon |
|
Teadmata |
|||
|
|
|
|
|
|
|
|
Teadmata |
|
Närvisüsteemi häired |
Paresteesia |
|
|
|
|
Teadmata |
|
|
|
|
Hüpoesteesia |
|
|
|
|
Teadmata |
|
|
|
Trombootiline insult |
|
Teadmata |
|||
|
|
|
Embooliline insult |
|
|
|
Teadmata |
|
|
|
|
Peavalu C |
|
|
|
|
Sage |
|
|
|
Somnolentsus* |
|
|
|
Teadmata |
|
|
|
|
Pearinglus B |
|
|
|
|
Sage |

|
|
|
|
Düsgeusia* |
Teadmata |
Südame häired |
|
Müokardiinfarkt |
Teadmata |
||
|
|
|
|
Tahhükardia |
Teadmata |
Vaskulaarsed häired |
|
Tromboos Venoosne tromboos |
Teadmata |
||
|
|
|
|
Arteriaalne tromboos |
Teadmata |
|
|
|
|
Emboolia (trombemboolilised |
Teadmata |
|
|
|
|
tüsistused) |
Teadmata |
|
|
|
|
Hüpotensioon C |
Sage |
|
|
|
|
Hüpertensioon |
Teadmata |
|
|
|
|
Punetus |
Teadmata |
Respiratoorsed, rindkere |
Kopsuemboolia |
Teadmata |
|||
ja mediastiinumi häired |
|
Bronhospasm |
Teadmata |
||
|
|
|
|
Vilisev hingamine |
Teadmata |
|
|
|
|
Köha |
Teadmata |
|
|
|
|
Düspnoe* |
Teadmata |
Seedetrakti häired |
|
Oksendamine |
Teadmata |
||
|
|
|
|
Kõhulahtisus |
Teadmata |
|
|
|
|
Ebamugavustunne kõhus |
Teadmata |
|
|
|
|
Iiveldus* |
Teadmata |
Naha |
ja |
nahaaluskoe |
Tuimustunne näos |
Teadmata |
|
kahjustused |
|
|
Angioödeem |
|
|
|
|
|
|
Urtikaaria |
|
|
|
|
|
Pruritus |
Teadmata |
|
|
|
|
Lööve |
Teadmata |
|
|
|
|
|
Teadmata |
|
|
|
|
|
Sage |
Üldised |
|
häired |
ja |
Valu süstekohal |
Teadmata |
manustamiskoha |
|
Halb enesetunne |
Teadmata |
||
reaktsioonid |
|
|
Kuumatunne |
Teadmata |
|
|
|
|
|
Külmavärinad* |
Teadmata |
|
|
|
|
Püreksia* |
Teadmata |
|
|
|
|
Valu rindkeres* |
Teadmata |
|
|
|
|
Ebamugavustunne rindkeres* |
Teadmata |
Uuringud |
|
|
Vererõhu langus |
Teadmata |
|
|
|
|
|
Hepatiit B pinnaantigeeni vastased |
Sage |
|
|
|
|
antikehad positiivsed C |
|
* Nende kõrvaltoimete täpset esinemissagedust ei ole olemasolevate andmete alusel võimalik hinnata.
A Inhibiitori tiitri suurenemine (anamnestiline reaktsioon) [ei ole MedDRA eelistermin] on pärast FEIBA manustamist tekkiv olemasolevate inhibiitori tiitrite suurenemine. Vt lõik 4.4.
B Kõrvaltoimed, mis on registreeritud algupärastes ja profülaktika uuringutes. Näidatud sagedus on ainult profülaktika uuringust.
C Kõrvaltoimed, mis on registreeritud profülaktika uuringus. Näidatud sagedus on profülaktika uuringust.
Ravimiklassiga seotud reaktsioonid
Muud ülitundlikkusreaktsioonide sümptomid plasmast toodetud ravimpreparaatide suhtes on letargia ja rahutus.
Võimalikest kõrvaltoimetest teatamine
Feiba võimalikest kõrvaltoimetest on oluline teavitada ka pärast ravimi müügiloa väljastamist. See võimaldab jätkuvalt hinnata Feiba kasu/riski suhet. Tervishoiutöötajatel palutakse teatada kõigist võimalikest kõrvaltoimetest www.ravimiamet.ee kaudu.
4.9 Üleannustamine
Mõned teatatud trombemboolilistest sündmustest tekkisid suuremate kui 200 Ü/kg annuste manustamisel. Kui täheldatakse trombembooliliste sündmuste nähte ja sümptomeid, tuleb infusioon kohe katkestada ning alustada sobivate diagnostiliste ja ravimeetmetega. Vt lõik 4.4.
5. FARMAKOLOOGILISED OMADUSED
5.1 Farmakodünaamilised omadused
Farmakoterapeutiline rühm: Antihemorraagilised ained, faktor VIII inhibiitorist möödamineva aktiivsusega hüübimisfaktorid,
Kuigi Feiba töötati välja
5.2 Farmakokineetilised omadused
Et Feiba koosneb mitmest erinevate poolväärtusaegadega koagulatsioonifaktoritest, ei ole Feiba farmakokineetiliste omaduste kohta võimalik teha lõplikke järeldusi.
5.3 Prekliinilised ohutusandmed
Vastavalt ägeda toksilisuse uuringutele normaalsetel hiirtel ja rottidel ning mõjustatud FVIII- ga hiirtel annustes, mis ületasid inimese maksimaalse ööpäevase annuse (st >200 Ü/kg), võib järeldada, et Feiba`ga seotud kõrvaltoimed on esmajoones tingitud preparaadi farmakoloogilise omaduse- hüperkoagulatsiooni- tulemus.
Korduvannuse toksilisuse uuring loomadel ei ole võimalik heteroloogiliste proteiinide vastaste antikehade tekke segava mõju tõttu.
Kuna inimvere koagulatsioonifaktoritel ei ole täheldatud kartsinogeenseid või mutageenseid toimeid, ei ole eksperimentaaluuringute läbiviimist, eriti heteroloogilistel liikidel, peetud vajalikuks.
6. FARMATSEUTILISED ANDMED
6.1 Abiainete loetelu
Pulber
Naatriumkloriid
Naatriumtsitraat
Lahusti
Steriliseeritud süstevesi
6.2 Sobimatus
Seda ravimpreparaati ei ole uuritud sobivuse suhtes teiste ravimitega, seepärast ei tohi Feiba’t segada teiste ravimpreparaatide või lahustitega. Enne ja pärast Feiba infusiooni on soovitatav tavapärast veeniteed loputada sobiva lahusega, nt isotoonilise soolalahusega.
Teatud tüüpi
6.3 Kõlblikkusaeg
2 aastat.
Ravimi kasutusaegne
6.4 Säilitamise eritingimused
Hoida temperatuuril kuni 25 °C. Mitte lasta külmuda.
Hoida viaal originaalpakendis, valguse eest kaitstult.
6.5 Pakendi iseloomustus ja sisu
Pulber on pindtöödeldud värvitust (II tüüpi hüdrolüütilisest) klaasist viaalis.
Lahusti on pindtöödeldud värvitust (I tüüpi hüdrolüütilisest) klaasist viaalis. Viaalid on suletud butüül kummist korgi ja kaitsekaanega.
Pakend suurusega 500 Ü/ 1000 Ü sisaldab : |
|
|
||
1 viaal 500Ü/1000 Ü FEIBAga |
või |
1 viaal 500Ü/1000 Ü FEIBAga |
||
1 viaal 20 ml steriliseeritud |
|
1 viaal 20 ml steriliseeritud süsteveega |
||
süsteveega |
|
|
|
|
ühekordselt kasutatav süstal |
|
BAXJECT II |
||
ühekordselt kasutatav nõel |
|
ühekordselt kasutatav süstal |
||
1 klambriga libliknõel |
|
ühekordselt kasutatav nõel |
||
1 filternõel |
|
1 klambriga libliknõel |
||
ülekandenõel
õhustamisnõel
6.6Erihoiatused ravimpreparaadi käsitsemiseks
Feiba süstelahuse valmistamiseks kasutada vaid steriliseeritud süstevett ja pakis sisalduvaid abivahendeid. Kogu protseduuri vältel tuleb kasutada aseptilist tehnikat. Feiba süstelahus tuleb valmistada vahetult enne manustamist ning kasutada kohe (lahus ei sisalda säilitusaineid).
Loksutage õrnalt keerates, kuni kogu pulber on lahustunud. Veenduge, et FEIBA on täielikult lahustunud; vastasel juhul pääseb vähem FEIBA ühikuid läbi seadme filtri.
Pärast lahuse valmistamist tuleb seda enne manustamist uurida tahkete osakeste ja värvuse muutuse suhtes. Kui lahus on hägune või sisaldab osakesi, siis ei tohi seda kasutada.
Toodet ei tohi kasutada. kui selle nõelavaba ülekandesüsteem, ülekandenõel steriilne barjäärisüsteem või pakend on kahjustatud või kui on muid märke, et toode on kasutamiseks kõlbmatu.
Kui Feiba manustamiseks kasutatakse muid vahendeid, tuleb veenduda, et kasutataval seadmel olev filter on piisava poorisuurusega, st vähemalt 149 µm.
Kasutamata ravim või jäätmematerjal tuleb hävitada vastavalt kohalikule seadusandlusele.
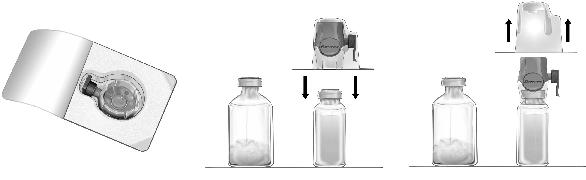
Süstelahuse valmistamine BAXJECT II
1.Vajaduse korral soojendada avamata lahustiviaal (steriliseeritud süstevesi) toatemperatuurini (15…25°C), näiteks kasutades mõne minuti vältel steriilset veevanni (maksimaalselt +37°C).
2.Eemaldada kontsentraadi- ja lahustiviaalidelt kaitsekaaned ja desinfitseerida mõlema pudeli kummikorgid. Asetada viaalid tasasele pinnale.
3.Avada BAXJECT II
4.Pöörata pakend ümber ja torgata läbipaistev plastteravik läbi lahusti korgi (Joonis b). Võtta pakendi servadest kinni ja tõmmata see
5.Pöörata BAXJECT süsteemiga lahustiviaal nii, et lahustiviaal oleks üleval. Torgata violetne plastteravik läbi kontsentraadiviaali kummikorgi. Vaakumi tõttu voolab lahusti kontsentraadipudelisse (Joonis d).
6.Keerutada kergelt, kuid mitte raputada, kuni kogu pulber on lahustunud. Veenduda, et Feiba oleks täielikult lahustunud, vastasel korral ei läbi toimeaine süsteemi filtrit.
Joonis a |
Joonis b |
Joonis c |
|
|
|
|
|
|
Juhised injektsiooniks/infusiooniks
1.Eemaldada sinine kork BAXJECT II
2.Pöörata süsteem ümber, nii et lahustunud Feiba viaal jääb üles. Kolbi aeglaselt tagasi tõmmates tõmmata lahus süstlasse ja veenduda, et kogu selle protseduuri ajal oleks süstal tihedalt ühendatud BAXJECT’iga (Joonis f).
3.Eemaldada süstal.
4.Kui süstlas on näha vahtu, oodata kuni selle kadumiseni. Süstida lahus liblikinfusioonikomplekti (või ühekordselt kasutatava nõela) abil aeglaselt veeni.
Joonis d |
Joonis e |
Joonis f |
|
|
|
Süstida ei tohi kiiremini kui 2 Ü/kg/min.
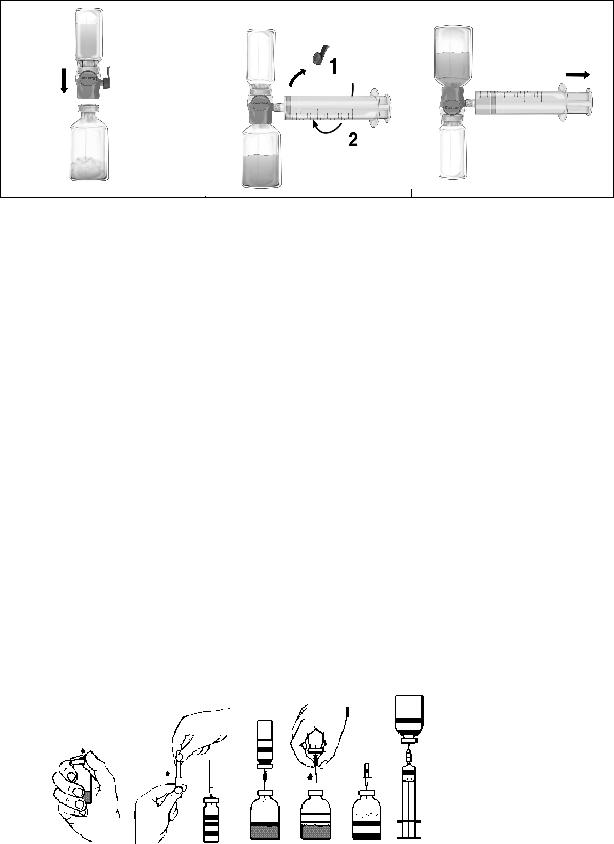
Süstelahuse valmistamine ülekandenõela abil:
1. Vajaduse korral soojendada avamata lahustipudel (steriliseeritud süstevesi) toatemperatuurini, näiteks kasutades mõne minuti vältel steriilset veevanni (maksimaalselt +37 °C).
2.Eemaldada kontsentraadi- ja lahustipudelitelt kaitsekaaned (Joonis A) ja desinfitseerida mõlema viaali kummikorgid.
3.Eemaldada ülekandenõela ühelt otsalt kaitse, seda keerates ja tõmmates (Joonis B). Suruda see nõel läbi lahustiviaali kummikorgi (Joonis C).
4.Eemaldada kaitsekate ülekandenõela teiselt otsalt, jälgides samal ajal, et nõela katmata ots ei puutuks kuskile vastu.
5.Pöörata lahustiviaal pulbriviaali kohale ja lükata vaba ülekandenõela ots läbi pulbriviaali kummikorgi (Joonis D). Lahusti tõmmatakse vaakumiga pulbriviaali.
6.Eraldada viaalid teineteisest, tõmmates nõela pulbriviaalist välja (Joonis E). Lahustumise kiirendamiseks loksutada või keerutada viaali kergelt.
7.Pärast pulbri täielikku lahustumist torgata korgist läbi kaasasolev õhustamisnõel (Joonis F) ja tekkinud vaht vajub kokku. Eemaldada õhustamisnõel.
Juhised injektsiooniks/infusiooniks:
Kogu protseduuri ajal kasutada aseptilist tehnikat.
1.Eemaldada kaasasolevalt filternõelalt kaitse seda keerates ja tõmmates ning sobitada filternõel kaasasolevale ühekordselt kasutatavale steriilsele süstlale. Tõmmata lahus süstlasse (Joonis G).
2.Eemaldada filternõel süstlalt ja süstida lahus kaasasoleva liblikinfusioonikomplekti (või ühekordselt kasutatava nõela) abil aeglaselt veeni.
A B C D E F G
Feiba süstimisel ei tohi ületada kiirust 2 Ü/kg/min.
7.MÜÜGILOA HOIDJA
Baxalta Innovations GmbH
Industriestrasse 67,
Austria
8.MÜÜGILOA NUMBRID
9. ESMASE MÜÜGILOA VÄLJASTAMISE/MÜÜGILOA UUENDAMISE KUUPÄEV
20.3.1996/19.10.2011
10.TEKSTI LÄBIVAATAMISE KUUPÄEV
august 2016
