Vistabel - süstelahuse pulber (4tü 0.1ml) - Ravimi omaduste kokkuvõte
Artikli sisukord
RAVIMI OMADUSTE KOKKUVÕTE
1.RAVIMPREPARAADI NIMETUS
VISTABEL, 4 Allergani ühikut/0,1 ml, süstelahuse pulber
2.KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS
INN. Clostridium botulinum toxin
Allergani ühikud ei ole võrdväärsed teiste botulinum toksiini preparaatidega.
50 ühikut viaalis.
Abiainete täielik loetelu vt lõik 6.1.
3.RAVIMVORM
Süstelahuse pulber.
Valge pulber
4.KLIINILISED ANDMED
4.1Näidustused
VISTABEL’i kasutamine on näidustatud täiskasvanutel ajutiseks välimuse parandamiseks, juhul kui järgmiste näokortsude sügavus põhjustab neile olulist psühholoogilist ebamugavust:
−maksimaalse kulmukortsutamise ajal esile tulevad mõõdukad kuni sügavad kulmudevahelised vertikaalkortsud (glabellaarkortsud),
−maksimaalse naeratuse ajal esile tulevad mõõdukad kuni sügavad lateraalsed silmanurkades asuvad kortsud (kanavarbad),
−maksimaalse naeratuse ajal esile tulevad mõõdukad kuni sügavad kanavarbad ja maksimaalse kulmukortsutamise ajal esile tulevad glabellaarkortsud, kui neid ravitakse üheaegselt.
4.2Annustamine ja manustamisviis
Annustamine
Vt konkreetseid soovitusi iga allpool kirjeldatava näidustuse puhul eraldi.
Botulinum toksiini ühikud ei ole kohaldatavad teiste botulinum toksiini preparaatidele. Allergani ühikutes soovitatavad annused erinevad teistest botulinum toksiini preparaatidest.
Eakad patsiendid
VISTABEL’i 3. faasi kliiniliste uuringute andmed üle
Lapsed
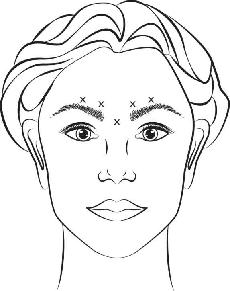
VISTABEL’i ohutust ja efektiivsust maksimaalse kulmukortsutamise ajal esile tulevate glabellaarkortsude või maksimaalse naeratuse ajal esile tulevate kanavarvaste ravis ei ole demonstreeritud alla
Manustamisviis
VISTABEL’i võib manustada ainult nõuetekohase kvalifikatsiooni ja kogemustega ning nõutavat varustust omav arst.
VISTABEL’i tohib pärast valmistamist kasutada ainult üheks süsti(de)ga ravikorraks ühele patsiendile. Kasutamata ravim tuleb hävitada nagu kirjeldatud lõigus 6.6. Eriti ettevaatlik tuleb olla ravimi ettevalmistamisel ja manustamisel, samuti inaktiveerimisel ja kasutamata lahuse hävitamisel (vt lõigud 4.4 ja 6.6).
Soovitatav süstekogus ühe lihase kohta on 0,1 ml. Vt ka lahjendustabelit lõigus 6.6.
Viaalide kasutuse, käsitluse ja hävitamise juhiste kohta vt lõik 6.6.
VISTABEL’i süstimisel maksimaalse kulmukortsutamise ajal esile tulevatesse kulmudevahelistesse vertikaalkortsudesse, mida nimetatakse ka glabellaarkortsudeks, või maksimaalse naeratuse ajal esile tulevatesse lateraalsetesse silmanurkades asuvatesse kortsudesse (ehk kanavarvastesse) tuleb olla ettevaatlik, et vältida VISTABEL’i sattumist veresoonde (vt lõik 4.4).
Manustamisjuhised maksimaalse kulmukortsutamise ajal esile tulevate glabellaarkortsude korral:
VISTABEL’i valmislahust (50 ühikut/1,25 ml) süstitakse steriilse 30 G nõela abil. 0,1 ml (4 ühikut) viiakse kõigisse 5 süstekohta (vt joonis 1): 2 süsti mõlemasse m. corrugator’isse ja 1 m. procerus’sse, koguannuses 20 ühikut.
Enne süstimist asetatakse pöial või nimetissõrm kindlalt silmapilu alla vältimaks ekstravasatsiooni silmapilust allapoole. Nõel peab süstimise ajal olema suunatud üles mediaalselt. Silmalau ptoosi riski vähendamiseks ei tohi ületada maksimaalset annust, 4 ühikut iga süstekoha kohta, samuti ei tohi ületada soovitatud süstekohtade arvu. Lisaks tuleb vältida süste ülalau tõsturlihase läheduses, eriti laia kulmu depressorlihase kompleksiga patsientidel. Süstid m. corrugator’isse peavad olema tehtud lihase keskosas, vähemalt 1 cm kulmukaarest kõrgemal.
Joonis 1:
Maksimaalse kulmukortsutamise ajal esile tulevate glabellaarkortsude sügavuse vähenemine toimub üldiselt ühe nädala jooksul pärast ravi. Raviefekti kestuseks on saadud kuni 4 kuud pärast süstimist.
Intervallid ravikordade vahel ei tohi olla lühemad kui kolm kuud. Ravi ebaõnnestumise või kahaneva toime korral pärast korduvaid süste tuleb rakendada alternatiivseid ravimeetodeid.
Manustamisjuhised maksimaalse naeratuse ajal esile tulevate kanavarvaste korral:
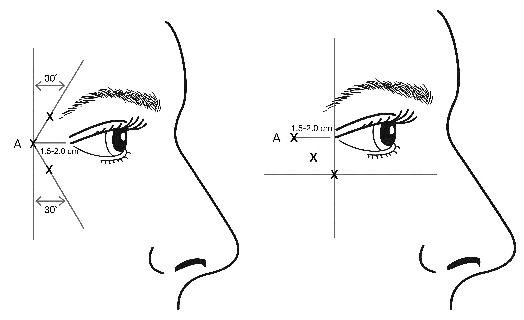
VISTABEL’i valmislahust (50 ühikut/1,25 ml) süstitakse steriilse 30 G nõela abil. 0,1 ml (4 ühikut) viiakse kõigisse 3 süstekohta ühel näopoolel (kokku 6 süstekohta) lateraalsesse orbicularis oculi lihasesse koguannuses 24 ühikut kogumahuga 0,6 ml (12 ühikut näopoole kohta).
Silmalau ptoosi riski vähendamiseks ei tohi ületada maksimaalset annust, 4 ühikut iga süstekoha kohta, samuti ei tohi ületada soovitatud süstekohtade arvu. Lisaks tuleb süstida orbitaalsest teljest veidi oimuluu poole, säilitades seejuures ohutu kauguse ülalau tõsturlihasest.
Süsted tuleb teostada nii, et nõelaots oleks suunatud kaldega üles ja suunaga silmast eemale. Esimene süst (A) tuleb teha ligikaudu 1,5 kuni 2,0 cm lateraalsest silmanurgast oimuluu poole ja orbitaalsest teljest veidi oimuluu poole. Kui kanavarvaste piirkonnas asuvad kortsud paiknevad üleval ja allpool lateraalset silmanurka, süstige, nagu on näidatud joonisel 2. Alternatiivselt, kui kanavarvaste piirkonnas asuvad kortsud asuvad peamiselt allpool lateraalset silmanurka, süstige, nagu on näidatud joonisel 3.
Joonis 2: |
Joonis 3: |
Maksimaalse naeratuse ajal esile tulevate kanavarvaste ja maksimaalse kulmukortsutamise ajal esile tulevate glabellaarkortsude üheaegsel töötlemisel tuleb manustada 24 ühikut kanavarvastesse ja 20 ühikut glabellaarkortsudesse (vt manustamisjuhised glabelaarkortsudesse ja joonist 1), koguannusena 44 ühikut kogumahus 1,1 ml.
Ravi käigus toimus uurija hinnangul maksimaalse naeratuse ajal esile tulevate kanavarvaste sügavuse vähenemine 1 nädala jooksul. Selle efekti mediaanne püsimisaeg oli 4 kuud alates süstimise ajast.
Ravi ei tohi toimuda sagedamini kui
Üldine informatsioon
Ravi ebaõnnestumise puhul pärast esimest ravikorda, st olulisel paranemise puudumisel üks kuu pärast süstimist võrreldes esialgse olukorraga, võib kaaluda järgmisi lähenemisviise:
-Ebaõnnestumise põhjuste analüüs, nt süstitud ebaõigetesse lihastesse, süstimistehnika, toksiini neutraliseerivate antikehade teke, ebapiisav annus;
-Ravi olulisuse hindamine
Juhul kui pärast esimest ravikuuri puuduvad kõrvaltoimed, alustage teise ravikuuriga, jättes kahe ravikuuri vahele vähemalt kolme kuu pikkuse intervalli.
Maksimaalse kulmukortsutamise ajal esile tulevate glabellaarkortsude suhtes ebapiisava annuse korral alustage teist ravikorda koguannuse kohandamisega 40 või 50 ühikuni, arvestades eelneva ravi ebaõnnestumise analüüsi tulemusi.
VISTABEL’i efektiivsust ja ohutust korduval süstimisel kauem kui 12 kuud ei ole uuritud.
4.3Vastunäidustused
VISTABEL on vastunäidustatud:
-isikutele, kellel on teada ülitundlikkus
-myasthenia gravis’e või Eaton Lambert’i sündroomi korral;
-infektsiooni korral pakutud süstekohtades.
4.4Erihoiatused ja ettevaatusabinõud kasutamisel
Erilisi ettevaatusabinõusid tuleb järgida nii toote valmistamisel, manustamisel, kui ka allesjäänud kasutamata lahuse inaktiveerimisel ja hävitamisel (vt lõigud 4.2 ja 6.6).
See ravimpreparaat sisaldab alla 1 mmol (23 mg) naatriumi annuse kohta, s.t on peaaegu „naatriumivaba“.
Vastava piirkonna anatoomia ja kõik kõrvalekalded selles, eelnevate kirurgiliste protseduuride tõttu, peavad olema teada enne VISTABEL’i manustamist ja vältida tuleb süstimist õrnadesse anatoomilistesse piirkondadesse.
VISTABEL’i soovituslikke annuseid ja manustamissagedust ei tohi ületada.
Väga harva võib pärast Clostridium botulinum’i toksiini süstimist esineda anafülaktiline reaktsioon. Epinefriin (adrenaliin) või muud
Patsientidel, kellel on diagnoosimata neuromuskulaarsed häired, võib olla suurem risk kliiniliselt oluliste süsteemsete toimete tekkeks, sh raske düsfaagia ja hingamisteede häired
VISTABEL’i tuleb ettevaatlikult kasutada ka patsientidel, kes põevad amüotroofilist lateraalskleroosi või perifeersete neuromuskulaarsete häirete esinemisel.
Botulinum toksiini preparaatidega on väga harva esinenud kõrvaltoimeid, mis võivad olla seotud toksiini sattumisega manustamiskohast eemale (vt lõik 4.8). Patsiendid, kes saavad soovitatud annuseid, võivad kogeda liigset lihasnõrkust. Neelamis- ja hingamisraskused on tõsised ja võivad
põhjustada surma. VISTABEL’i kasutamine ei ole soovitav patsientidele, kellel on esinenud düsfaagiat ja aspiratsiooni.
Patsientidele või hooldajatele tuleb soovitada pöörduda viivitamatult arstiabi saamiseks, kui tekivad
Liiga sage või ülemäärane annustamine võib suurendada antikehade tekke riski. Antikehade teke võib põhjustada ravi ebaõnnestumise
Nagu võib oodata igal süstimisprotseduuril, võib süstimisega kaasneda lokaliseeritud valu, põletik, paresteesia, hüpesteesia, hellus, paistetus/turse, punetus, lokaliseerunud infektsioon, verejooks ja/või verevalum. Nõelatorkega seotud valu ja/või ärevus võib põhjustada vasovagaalset reaktsiooni, sh mööduvat sümptomaatilist hüpotensiooni ja minestust.
VISTABEL’i kasutamisel tuleb olla ettevaatlik, kui eeldatavas süstekohas on põletik või kui sihtlihastes esineb väljendunud nõrkus või atroofia.
VISTABEL’i süstimisel maksimaalse kulmukortsutamise ajal esile tulevatesse glabellaarkortsudesse või maksimaalse naeratuse ajal esile tulevatesse kanavarvastesse tuleb olla ettevaatlik, et vältida VISTABEL’i sattumist veresoonde (vt lõik 4.2).
Ravijärgselt esineb silmalaugude vaje oht, vt lõik 4.2 manustamisjuhistest, kuidas seda riski vähendada.
VISTABEL’i ei soovitata kasutada alla
4.5Koostoimed teiste ravimitega ja muud koostoimed
Teoreetiliselt võivad aminoglükosiidi tüüpi antibiootikumid, spektinomütsiin või teised ravimid, mis mõjutavad neuromuskulaarset ülekannet (nt müorelaksandid), potentseerida Clostridium botulinum’i toksiini toimet.
Erinevate botulinum neurotoksiini serotüüpide vastastikune toime kasutamisel samaaegselt või mitmete kuude jooksul ei ole teada. Väljendunud neuromuskulaarne nõrkus võib süveneda ühe botulinum toksiini manustamisel enne teise, eelnevalt manustatud botulinum toksiini toime möödumist.
Spetsiifilisi katseid, selgitamaks võimalikku vastastikust toimet teiste ravimitega, pole läbi viidud. Teisi kliiniliselt olulisi vastastikuseid toimeid ei ole selle näidustuse korral täheldatud.
4.6Fertiilsus, rasedus ja imetamine
Rasedus
Imetamine
Puuduvad andmed VISTABEL’i eritumise kohta inimese rinnapiima.
Fertiilsus
4.7Toime reaktsioonikiirusele
Uuringuid toime kohta autojuhtimise ja masinate käsitsemise võimele ei ole läbi viidud. Kuid VISTABEL võib põhjustada asteeniat, lihaste nõrkust, pearinglust ja nägemishäireid, mis võivad mõjutada autojuhtimist ja masinatega töötamist.
4.8Kõrvaltoimed
a)Üldised
Kontrollitud kliinilistes uuringutes maksimaalse kulmukortsutamise ajal esile tulevate glabellaarkortsude kohta esines uurijate arvates VISTABEL'iga seotud kõrvaltoimeid 23,5% (platseebo: 19,2%) patsientidest. Maksimaalse naeratuse ajal esile tulevate kanavarvaste otsustava tähtsusega kontrollitud kliiniliste uuringute 1. ravitsüklis täheldati selliseid nähte 7,6% (24 ühikut manustatud ainult kanavarvastele) ja 6,2% (44 ühikut: 24 ühikut manustatud kanavarvastele ja samaaegselt 20 ühikut glabellaarkortsudele) patsientidest võrreldes 4,5% platseebot saanud patsientidega. Need kõrvaltoimed võivad olla seotud raviga, süstimisvõtetega või mõlemaga. Üldiselt ilmnevad kõrvaltoimed mõne esimese päeva jooksul pärast süstimist ning on mööduvad. Enamus täheldatud kõrvaltoimetest on olnud kerge kuni mõõduka raskusastmega.
Oodatav Clostridium botulinum’i toksiini farmakoloogiline mõju on paikne lihasnõrkus. Siiski on teatatud süstekoha lähedal ja/või kaugemal asuvate lihaste nõrkusest. Blefaroptoos, mis võib olla seotud manustamistehnikaga, on kooskõlas VISTABEL’i farmakoloogilise mõjuga. Nagu võib oodata igal süstimisprotseduuril, võib süstimisega kaasneda
b)Kõrvaltoimed - esinemissagedus
Kõrvaltoimed on klassifitseeritud organsüsteemi klassi järgi ja esinemissagedus on määratud järgmiselt: väga sage (≥1/10); sage (≥1/100, <1/10);
Glabellaarkortsud
Organsüsteemi klass |
Eelistatud termin |
Esinemissagedus |
|
|
|
Infektsioonid ja infestatsioonid |
Infektsioon |
|
|
||
|
|
|
Psühhiaatrilised häired |
Ärevus |
|
|
||
|
|
|
Närvisüsteemi häired |
Peavalu, paresteesia |
Sage |
|
||
|
|
|
|
Pearinglus |
|
|
|
|
Silma kahjustused |
Silmalau vaje |
Sage |
|
||
|
|
|
|
Blefariit, silmavalu, nägemishäired (sh |
|
|
ähmane nägemine |
|
|
|
|
Seedetrakti häired |
Iiveldus |
Sage |
|
||
|
|
|
|
Suukuivus |
|
|
|
|
Naha ja nahaaluskoe |
Erüteem, naha pingulolek |
Sage |
|
||
|
|
|
kahjustused |
Turse (näol, silmalaugudel, periorbitaalne), |
||
|
|||
|
valgustundlikkuse reaktsioon, pruuritus, |
|
|
|
kuiv nahk |
|
|
|
|
|
|
Paikne lihasnõrkus |
Sage |
||
kahjustused |
|
|
|
Lihaste tõmblused |
|||
|
|||
|
|
|
|
Üldised häired ja |
Näovalu, süstekoha turse, verevalum, |
Sage |
|
manustamiskoha reaktsioonid |
|||
süstekoha valu, süstekoha ärritus |
|
||
|
|
||
|
|
|
|
|
Gripilaadne sündroom, asteenia, palavik |
||
|
|
|
Kanavarbad
Järgmisi kõrvaltoimeid täheldati topeltpimedates, platseebokontrollitud kliinilistes uuringutes VISTABEL’i 24 ühiku manustamisel ainult kanavarvastele:
Organsüsteemi klass |
Eelistatud termin |
Esinemissagedus |
|
|
|
|
|
Silma kahjustused |
Silmalau ödeem |
Sage |
|
|
|||
|
|
|
|
Üldised häired ja |
Süstekoha verevalum*, süstekoha |
Sage |
|
manustamiskoha reaktsioonid |
|||
hematoom* |
|
||
|
|
||
|
|
|
|
|
Süstekoha valu*, süstekoha vääraisting |
||
|
|
|
|
* protseduuriga seotud kõrvaltoimed |
|
||
Kanavarbad ja glabellaarkortsud
Järgmisi kõrvaltoimeid täheldati topeltpimedates, platseebokontrollitud kliinilistes uuringutes VISTABEL’i 44 ühiku manustamisel samaaegselt kanavarvastele ja glabellaarkortsudele:
Organsüsteemi klass |
Eelistatud termin |
Esinemissagedus |
|
|
|
|
|
Üldised häired ja |
Süstekoha hematoom* |
Sage |
|
manustamiskoha reaktsioonid |
|||
|
|
||
Süstekoha verevalum*, süstekoha valu* |
|||
|
|||
|
|
|
* protseduuriga seotud kõrvaltoimed
Üldises ohutusprofiilis pärast korduvat annustamist muutusi ei täheldatud.
c)Turuletulekujärgsed andmed (sagedus teadmata)
Järgmisi kõrvaltoimeid või meditsiiniliselt olulisi kõrvaltoimeid on täheldatud sellest ajast, kui ravim on müügil glabellaarkortsude raviks, kanavarvaste raviks ja teistel kliinilistel näidustustel:
Organsüsteemi klass |
Eelistatud termin |
|
|
Immuunsüsteemi häired |
Anafülaksia, angioödeem, seerumtõbi, nõgestõbi |
|
|
Ainevahetus- ja toitumishäired |
Isutus |
|
|
Närvisüsteemi häired |
Brahhiaalne pleksopaatia, kähehäälsus, düsartria, näo parees, |
|
hüpesteesia, lihasnõrkus, myasthenia gravis, perifeerne |
|
neuropaatia, paresteesia, radikulopaatia, minestus, näonärvi |
|
halvatus |
|
|
Silma kahjustused |
Suletudnurga glaukoom (blefarospasmi raviks), lagoftalm, |
|
strabism, ähmane nägemine, nägemishäired |
|
|
Kõrva ja labürindi kahjustused |
Hüpoakuusia, tinnitus, vertiigo |
|
|
Respiratoorsed, rindkere ja |
Aspiratsioonipneumoonia, düspnoe, bronhospasm, |
mediastiinumi häired |
respiratoorne depressioon, hingamispuudulikkus |
|
|
Seedetrakti häired |
Kõhuvalu, kõhulahtisus, suukuivus, düsfaagia, iiveldus, |
|
oksendamine |
|
|
Naha ja nahaaluskoe kahjustused |
Alopeetsia, psoriaasitaoline dermatiit, erythema multiforme, |
|
hüperhidroos, madaroos, pruritus, nahalööve |
|
|
Lihaste atroofia, lihasvalu |
|
|
|
Üldised häired ja manustamiskoha |
Denervatsioonatroofia, halb enesetunne, palavik |
reaktsioonid |
|
|
|
Botuliini toksiini preparaatidega on väga harva esinenud kõrvaltoimeid, mis võivad olla seotud toksiini sattumisega manustamiskohast eemale (nt. lihasnõrkus, düsfaagia, kõhukinnisus või aspiratsioonipneumoonia, mis võib lõppeda surmaga) (vt lõik 4.4).
Võimalikest kõrvaltoimetest teavitamine
Ravimi võimalikest kõrvaltoimetest on oluline teavitada ka pärast ravimi müügiloa väljastamist. See võimaldab jätkuvalt hinnata ravimi kasu/riski suhet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest kõrvaltoimetest www.ravimiamet.ee kaudu.
4.9Üleannustamine
VISTABEL'i üleannustamine on suhteline ja sõltub annusest, süstekohast ja alumiste kudede omadustest. Süsteemse toksilisuse juhtusid Clostridium botulinum’i toksiini juhusliku süstimise tagajärjel ei ole täheldatud. Liigne annus võib põhjustada lokaalset või süstekohast eemalolevat, generaliseerunud ja rasket neuromuskulaarset halvatust. Ei ole täheldatud ühtegi
Üleannustamise tunnused ei ilmne vahetult pärast süstimist. Kui juhuslik süstimine või suukaudne sissevõtmine peaks aset leidma, tuleb patsienti jälgida mitme päeva jooksul üldise nõrkuse ja lihaste halvatuse sümptomite suhtes. Patsiendi hospitaliseerimist tuleks kaaluda juhul, kui esinevad
5.FARMAKOLOOGILISED OMADUSED
5.1Farmakodünaamilised omadused
Farmakoterapeutiline rühm: perifeerse toimega müorelaksandid,
Süstimise järgselt toimub toksiini esialgne kiire, kõrge afiinsusega seondumine spetsiifiliste rakumembraani retseptoritega. Sellele järgneb toksiini ülekanne läbi plasmamembraani retseptori poolt
vahendatud endotsütoosi teel. Lõpuks vabaneb toksiin tsütoplasmasse. Viimasega kaasneb progresseeruv atsetüülkoliini vabanemise inhibeerimine, kliinilised nähud ilmnevad 2...3 päeva jooksul. Toime kõrghetk saabub 5...6 nädala jooksul pärast süstimist.
Taastumine pärast intramuskulaarset süsti leiab tavaliselt aset 12 nädalat pärast süstimist, kuna närvisünapsid taastuvad ja ühenduvad uuesti
Kliinilised andmed:
Glabellaarkortsud
Kliinilistesse uuringutesse oli kaasatud 537 patsienti, kellel olid maksimaalse kulmukortsutamise ajal esile tulevad mõõdukad kuni tugevasti väljendunud glabellaarkortsud.
VISTABEL’i süstid silusid oluliselt maksimaalse kulmukortsutamise ajal esile tulevate glabellaarkortsude sügavust kuni 4 kuu jooksul, mis põhines uurija hinnangul glabellaarkortsude sügavuse kohta maksimaalsel kulmukortsutamisel ja globaalsel hinnangul isiku maksimaalse kulmukortsutamise ajal esile tulevate glabellaarkortsude kohta. Kliiniliste uuringute tulemused ei sisaldanud psühholoogilise mõju objektiivset hindamist. Kolmkümmend päeva pärast süsti loeti 80% (325/405) VISTABEL’iga ravitud patsientidest uurijate poolt ravile reageerinuteks (kortsude kadumine või kerge aste maksimaalsel kulmukortsutusel), võrreldes
VISTABEL’i süstid vähendasid glabellaarkortsude sügavust ka rahuolekus.
Kliinilised andmed VISTABEL’i 3. faasi uuringutest üle
Kanavarbad
Kliinilistesse uuringutesse oli kaasatud 1362 patsienti, kellel olid maksimaalsel naeratamisel mõõdukad kuni tugevasti väljendunud kas ainult kanavarbad (N = 445, uuring
VISTABEL’i süstid silusid oluliselt maksimaalse naeratuse ajal esile tulevate kanavarvaste sügavust võrreldes platseeboga kõigis ajapunktides (p < 0,001) kuni 5 kuu jooksul. Seda mõõdeti mõlemas otsustava tähtsusega uuringus kanavarvaste sügavuse hindamisel maksimaalse naeratuse korral hinnanguks nende puudumise kuni nõrgalt väljendumise saanud patsientide osakaalu järgi; kuni 150. päevani (uuringu lõpuni) uuringus
Uuringus
Tabel 1. 30. päev: uurijate ja patsientide hinnangud kanavarvastele maksimaalse naeratuse korral – ravimivastuse esinemissagedus (patsientide %, kes said kanavarvaste sügavuse hinnanguks nende puudumise või nõrga väljendumise).
Kliiniline |
Annus |
VISTABEL |
Platseebo |
VISTABEL |
Platseebo |
uuring |
|
|
|
|
|
|
|
Uurija hinnang |
|
Patsiendi hinnang |
|
|
|
|
|
|
|
24 ühikut |
66,7%* |
6,7% |
58,1%* |
5,4% |
|
|
(kanavarbad) |
(148/222) |
(15/223) |
(129/222) |
(12/223) |
|
|
||||
|
|
|
|
|
|
24 ühikut |
54,9%* |
3,3% |
45,8%* |
3,3% |
|
|
(kanavarbad) |
(168/306) |
(10/306) |
(140/306) |
(10/306) |
|
|
||||
|
44 ühikut |
59,0%* |
3,3% |
48,5%* |
3,3% |
|
(24 ühikut kanavarbad; |
(180/305) |
(10/306) |
(148/305) |
(10/306) |
|
20 ühikut |
|
|
|
|
|
glabellaarkortsud) |
|
|
|
|
|
|
|
|
|
|
*p < 0,001 (VISTABEL vs platseebo)
Maksimaalse naeratamise ajal esile tulevate kanavarvaste algse välimusega võrreldes täheldati pärast VISTABEL’i (24 ühikut ja 44 ühikut) manustamist patsientide hinnangute kohaselt paranemist võrreldes platseebot saanutega 30. päeval ja kõigis ajapunktides, mis järgnesid igale ravitsüklile mõlemas otsustava tähtsusega uuringus (p < 0,001).
VISTABEL’i 24 ühiku manustamine vähendas samuti oluliselt kanavarvaste sügavust näo puhkeolekus. 528 ravitud patsiendist 63% (330/528) olid enne ravi näo puhkeolekus mõõdukad kuni sügavad kanavarbad. Neist loeti 30. päeval pärast süstimist ravile allunuteks (puuduvad või nõrgad kanavarbad) 58% (192/330) VISTABEL’iga ravitud patsientidest, platseebot saanud patsientide hulgas oli see määr 11% (39/352).
VISTABEL’i (24 ühikut ja 44 ühikut) saanute hulgas paranes ka inimeste enesehinnang oma vanusele ja atraktiivsusele võrreldes platseebot saanutega. Hindamiseks kasutati näokortsude ravitulemuste
Otsustava tähtsusega uuringutes osalenud patsientidest olid 3,9% (53/1362) vanemad kui 65 eluaastat. Selle vanusegrupi patsiendid said uurija hinnangu kohaselt VISTABEL’i (24 ühikut ja 44 ühikut) ravivastuse esinemissageduseks 36% (30. päeval). Analüüsides vanuserühmi ≤
Üldine ravivastus VISTABEL’ile oli maksimaalse naeratamise ajal esile tulevate kanavarvaste korral nõrgem (60%) kui maksimaalse kulmukortsutamise ajal esile tulevate glabellaarkortsude korral (80%).
916 VISTABEL’iga ravitud patsiendi (517 patsienti, kes said 24 ühikut, ja 399 patsienti, kes said 44 ühikut) proove analüüsiti antikehade moodustamise osas. Ühelgi patsiendil ei moodustunud neutraliseerivaid antikehi.
5.2Farmakokineetilised omadused
a)Toimeaine üldine iseloomustus:
Jaotumise uuringud rottidel näitasid süstimise järgselt sääre kakspealihasesse
Klassikalisi toimeaine imendumise, jaotumise, biotransformatsiooni ja eritumise (ADME) uuringuid ei ole tehtud selle toote eripära tõttu.
b)Iseloomustus patsientidel:
Arvatakse, et terapeutiliste annuste korral leiab aset VISTABEL’i süsteemne jaotumine. Kliinilised uuringud üksiku kiu elektromüograafiat kasutades on näidanud suurenenud elektrofüsioloogilist neuromuskulaarset aktiivsust süstekohast kaugemal asuvates lihastes, ilma kaasuvate kliiniliste nähtude või sümptomiteta.
5.3Prekliinilised ohutusandmed
Reproduktiivsuse uuringutes hiirtel, rottidel ja küülikutel täheldati suurte annuste korral embrüotoksilisust (hilinenud ossifikatsioon ja vähenenud loote kehakaal). Teratogeenset toimet neil liikidel ei ilmnenud. Rottidel esines isasloomade fertiilsuse ning emasloomade ovulatsioonitsükli ja fertiilsuse häireid ainult suurte annuste korral.
Ägeda toksilisuse, korduva annuse toksilisuse, paikse taluvuse, mutageensuse, antigeensuse ja veresobivuse uuringud ei näidanud ebaharilikke lokaalseid ega süsteemseid kõrvaltoimeid kliiniliselt oluliste annuste korral.
6.FARMATSEUTILISED ANDMED
6.1Abiainete loetelu
Humaanalbumiin
Naatriumkloriid
6.2Sobimatus
Sobivusuuringute puudumisel ei tohi seda ravimpreparaati teiste ravimitega segada.
6.3Kõlblikkusaeg
3 aastat.
Pärast lahuse valmistamist on soovitav selle kohene kasutamine. Siiski on tõestatud lahuse keemiline ja füüsikaline stabiilsus kasutamisel kuni 24 tunni jooksul 2°...8°C juures.
6.4Säilitamise eritingimused
Hoida külmkapis (2°C...8°C).
Valmislahuse säilitustingimuste kohta vt lõik 6.3.
6.5Pakendi iseloomustus ja sisu

Pulber viaalis (I tüüpi klaas), mis on varustatud korgi (kloorbutüülkummi või Lyoteci) ja pitseriga (alumiinium);
Viaal
KÕIK PAKENDI SUURUSED EI PRUUGI OLLA MÜÜGIL.
6.6Erihoiatused ravimpreparaadi hävitamiseks ja käsitlemiseks
Lahuse valmistamine peab toimuma hea tava kohaselt aseptilistes tingimustes. VISTABEL tuleb lahustada
Lisatava lahusti hulk |
|
Saadav annus |
|
(ühikuid 0,1 ml kohta) |
|
50 ühikut viaali jaoks |
|
|
1,25 ml |
|
4,0 ühikut |
Kummikorgi keskosa tuleb puhastada alkoholiga. |
|
|
Vältimaks VISTABEL’i denaturatsiooni, süstige lahusti aeglaselt viaali ja pöörake viaali õrnalt, vältides mullide teket. Viaal tuleb ära visata, kui vaakum ei tõmba lahust viaali. Valmistatud lahust tuleb enne kasutamist visuaalselt kontrollida. Kasutada võib ainult selget, värvitut või kergelt kollakat ning ilma tahkete osakesteta lahust.
Nõutav on, et VISTABEL’i kasutataks ainult ühe patsiendi raviks ühe ravikorra ajal.
Viaalide, süstalde ja kasutatud materjali ohutu hävitamise protseduur:
Vahetult pärast kasutamist tuleb kasutamata jäänud VISTABEL’i valmislahus enne äraviskamist viaalis ja/või süstlas inaktiveerida 2 ml lahjendatud hüpokloriidi lahusega
Kasutatud viaale, süstlaid ja materjale ei tohi tühjaks valada ning need peavad olema kogutud spetsiaalsetesse konteineritesse ja hävitatud nagu meditsiiniliselt ohtlikud jäätmed vastavalt kohalikele nõuetele.
Soovitused õnnetusjuhtumi puhul CLOSTRIDIUM BOTULINUM’i toksiini käsitlemisel.
Õnnetusjuhtumi puhul kas lüofiliseeritud või valmislahuse kujul oleva toote käsitlemisel tuleb viivitamatult tarvitusele võtta allkirjeldatud meetmed.
•Toksiin on väga tundlik kuumuse ja teatud keemiliste ainete suhtes
•Kogu mahavalgunud vedelik tuleb ära pühkida: kas naatriumhüpokloriidis (Javeli lahuses) leotatud imava materjaliga (lüofiliseeritud aine korral) või kuiva imava materjaliga (valmislahuse korral).
•Saastunud pinnad tuleb puhastada naatriumhüpokloriidis (Javeli lahuses) leotatud imava materjaliga ja siis kuivatada.
•Kui viaal on katki, toimige nagu ülal kirjeldatud, koguge klaasitükid ettevaatlikult kokku ja pühkige lahus ära, vältides sisselõikamist.

•Pritsmete sattumisel nahale peske need maha naatriumhüpokloriidiga (Javeli lahusega) ning seejärel loputage ohtra veega.
•Pritsmete sattumisel silma loputage hoolikalt rohke veega või silmaloputuslahusega.
•Juhul kui töötaja vigastab ennast (lõikab või torkab sisse), toimige ülalpool kirjeldatud kombel ja võtke tarvitusele vajalikud meditsiinilised meetmed vastavalt manustatud annusele.
Neid kasutamise, käsitlemise ja hävitamise juhiseid tuleb rangelt jälgida.
7.MÜÜGILOA HOIDJA
ALLERGAN PHARMACEUTICALS IRELAND
Castlebar Road
Westport
County Mayo
Iirimaa
8.MÜÜGILOA NUMBER
9.ESMASE MÜÜGILOA VÄLJASTAMISE/MÜÜGILOA UUENDAMISE KUUPÄEV
Müügiloa esmase väljastamise kuupäev: 04.02.2005
Müügiloa viimase uuendamise kuupäev: 07.06.2013
10.TEKSTI LÄBIVAATAMISE KUUPÄEV
Mai 2015
