Yanimo respimat - inhalatsioonilahus (2,5mcg +2,5mcg 1pihustus) - Ravimi omaduste kokkuvõte
Artikli sisukord
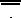
 Käesoleva ravimi suhtes kohaldatakse täiendavat järelevalvet, mis võimaldab kiiresti tuvastada uut ohutusteavet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest kõrvaltoimetest. Kõrvaltoimetest teavitamise kohta vt lõik 4.8.
Käesoleva ravimi suhtes kohaldatakse täiendavat järelevalvet, mis võimaldab kiiresti tuvastada uut ohutusteavet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest kõrvaltoimetest. Kõrvaltoimetest teavitamise kohta vt lõik 4.8.
1.RAVIMPREPARAADI NIMETUS
Yanimo Respimat, 2,5 mikrogrammi/2,5 mikrogrammi, inhalatsioonilahus
2.KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS
Üks inhaleeritav annus sisaldab 2,5 mikrogrammi tiotroopiumi (bromiidmonohüdraadina) ja 2,5 mikrogrammi olodaterooli (vesinikkloriidina) ühes pihustuses.
Inhaleeritav annus on see annus, mis on pärast huuliku läbimist patsiendi poolt kasutatav.
INN. Tiotropii bromidum, olodaterolum
Abiainete täielik loetelu vt lõik 6.1.
3.RAVIMVORM
Inhalatsioonilahus
Selge, värvitu inhalatsioonilahus.
4.KLIINILISED ANDMED
4.1Näidustused
Bronhodilateeriv säilitusravi kroonilise obstruktiivse kopsuhaigusega (KOK) täiskasvanutel sümptomite leevendamiseks.
4.2Annustamine ja manustamisviis
Annustamine
Ravim on ette nähtud kasutamiseks ainult inhalatsiooniks. Kolbampulli võib sisestada ainult Respimat inhalaatorisse ja kasutada ainult sellega.
Üks raviannus koosneb Respimat inhalaatori kahest pihustusest.
Täiskasvanud
Soovitatav annus on 5 mikrogrammi tiotroopiumi ja 5 mikrogrammi olodaterooli, manustades kaks pihustust Respimat inhalaatorist üks kord ööpäevas, iga päev samal ajal.
Soovitatavat annust ei tohi ületada.
Eakad
Eakad patsiendid võivad kasutada Yanimo Respimati soovitatud annuses.
Maksakahjustus ja neerukahjustus
Yanimo Respimat sisaldab tiotroopiumi, mis on peamiselt neerude kaudu erituv ravim, ja olodaterooli, mis metaboliseerub peamiselt maksas.
Maksakahjustus
Kerge ja mõõduka maksakahjustusega patsiendid võivad kasutada Yanimo Respimati soovitatavas annuses.
Puuduvad andmed olodaterooli kasutamise kohta raske maksakahjustusega patsientidel.
Neerukahjustus
Neerukahjustusega patsiendid võivad kasutada Yanimo Respimati soovitatavas annuses.
Mõõduka kuni raske neerukahjustusega (kreatiniini kliirens ≤ 50 ml/min) patsientide kohta vt lõigud 4.4 ja 5.2.
Yanimo Respimat sisaldab olodaterooli. Olodaterooli kasutamise kohta raske neerukahjustusega patsientidel on andmed piiratud.
Lapsed
Yanimo Respimati kasutamine lastel ja noorukitel (vanuses alla 18 aasta) ei ole asjakohane.
Manustamisviis
Ravimi õige manustamise tagamiseks peab arst või meditsiinitöötaja patsiendile näitama, kuidas inhalaatorit kasutada.
Kasutusjuhend
Sissejuhatus
Yanimo Respimat (tiotroopiumbromiid ja olodaterool). Enne Yanimo Respimati kasutamist lugege seda kasutusjuhendit.
Teil on vaja seda inhalaatorit kasutada ainult ÜKS KORD ÖÖPÄEVAS. Iga kord, kui te ravimit kasutate, manustage KAKS PIHUSTUST.
•Kui Yanimo Respimati ei ole kasutatud üle 7 päeva, siis pihustage üks pihustus suunaga allapoole.
•Kui Yanimo Respimati ei ole kasutatud üle 21 päeva, siis korrake lõigus „Esmakordseks kasutamiseks ettevalmistamine“ kirjeldatud etappe 4 kuni 6, kuni näete ravimipilve. Seejärel korrake etappe 4 kuni 6 veel kolm korda.
•Ärge puudutage augustuselementi läbipaistvas kattes.
Kuidas Yanimo Respimati hooldada
Puhastage huulikut ja temas paiknevat metallosa niiske lapi või pabersalvrätiga vähemalt üks kord nädalas.
Huuliku vähene värvuse muutus ei mõjuta Yanimo Respimat inhalaatori toimimist. Vajadusel puhastage Yanimo Repimat inhalaatori välispinda, pühkides niiske lapiga.
Millal võtta kasutusele uus Yanimo Respimat
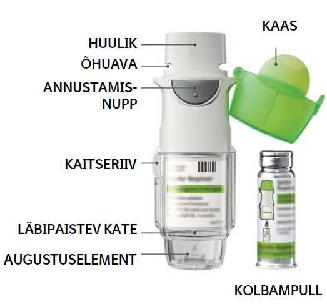
•Yanimo Respimat inhalaator sisaldab 60 pihustust (30 annust), kui seda vastavalt annustamisjuhisele kasutada (kaks pihustust üks kord ööpäevas).
•Annuseindikaator näitab ligikaudu, kui palju ravimit on alles.
•Kui osuti jõuab skaala punasesse piirkonda, vajate te uut retsepti. Ravimit on jäänud ligikaudu 7 päevaks (14 pihustust).
•Kui annuseindikaator on jõudnud punase skaala lõppu, lukustub Yanimo Respimat inhalaator automaatselt – rohkem annuseid ei saa pihustada. Selles olukorras ei saa läbipaistvat katet enam keerata.
•Yanimo Respimat tuleb ära visata kolm kuud pärast selle ettevalmistamist esmakordseks kasutamiseks, isegi kui kogu ravim ei ole ära kasutatud või on täielikult kasutamata.
Esmakordseks kasutamiseks ettevalmistamine
1. Eemaldage läbipaistev kate
•Hoidke kaas suletuna.
•Vajutage kaitseriivile, samal ajal teise käega läbipaistvat katet kindlalt ära tõmmates.
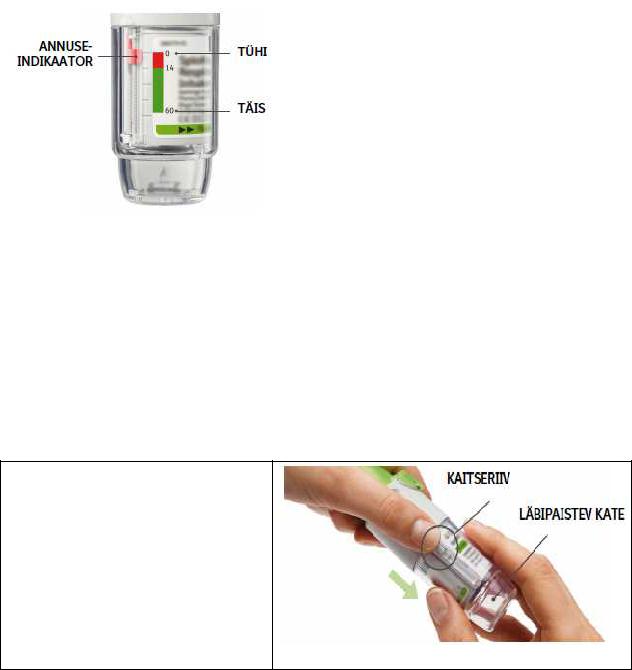
2.Sisestage kolbampull
•Sisestage kolbampulli kitsas ots inhalaatorisse.
•Asetage inhalaator kindlale pinnale ja vajutage kindlalt alla, kuni kolbampull plõksatab kohale.
•Ärge eemaldage kolbampulli, kui see on juba inhalaatorisse paigaldatud.
3.Paigutage läbipaistev kate tagasi
•Paigutage läbipaistev kate tagasi oma kohale, kuni see plõksatab.
•Ärge läbipaistvat katet seejärel enam eemaldage.
4.Keerake
•Hoidke kaas suletuna.
•Keerake läbipaistvat katet etiketil kujutatud nooltega märgistatud suunas, kuni see plõksatab (pool pööret).
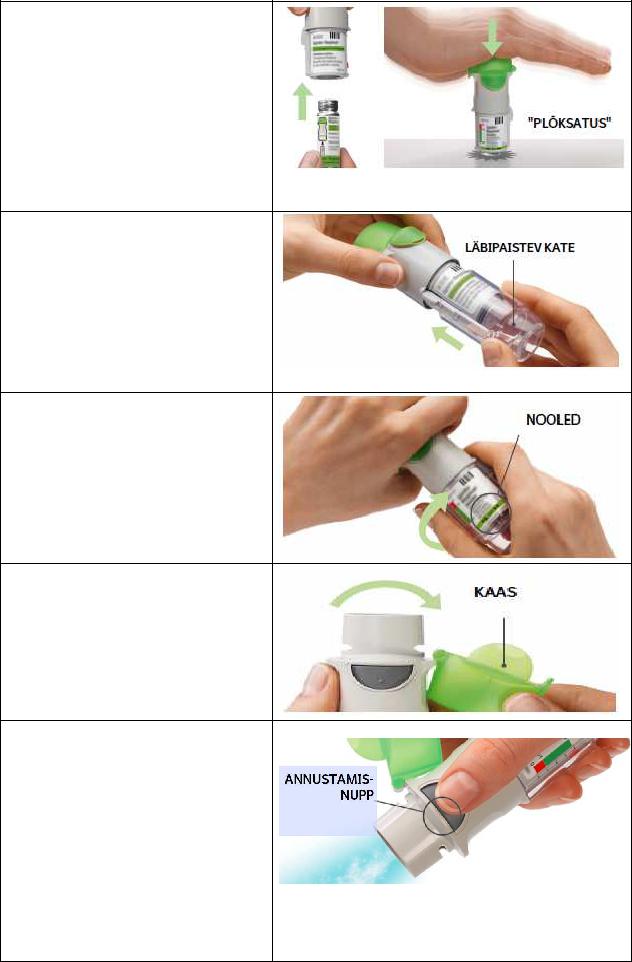
5.Avage
•Avage kaas, nii et see plõksatab täiesti lahti.
6.Vajutage
•Suunake inhalaator otsaga allapoole.
•Vajutage annustamisnupule.
•Sulgege kaas.
•Korrake etappe 4 kuni 6, kuni näete ravimipilve.
•Pärast seda, kui näete ravimipilve, korrake etappe 4 kuni 6 veel kolm korda.
Teie inhalaator on nüüd kasutusvalmis. Need etapid ei mõjuta kättesaadavate annuste arvu. Pärast ettevalmistamist saab inhalaatorist väljutada 60 pihustust (30 raviannust).
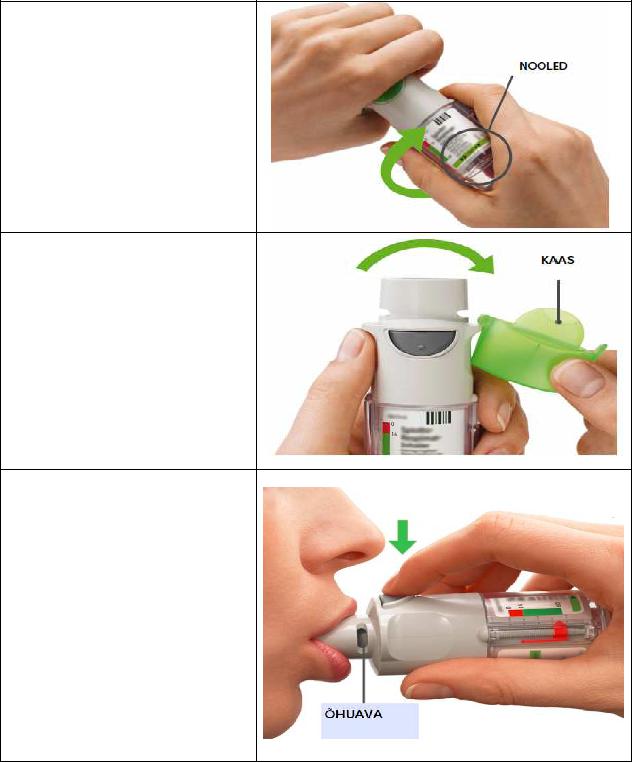
Igapäevane kasutamine
KEERAKE
•Hoidke kaas suletuna.
•KEERAKE läbipaistvat katet etiketil kujutatud nooltega märgistatud suunas, kuni see klõpsatab (pool pööret).
AVAGE
•AVAGE kaas, kuni see plõksatab täiesti lahti.
VAJUTAGE
•Hingake aeglaselt ja täielikult välja. Sulgege huuled ümber huuliku otsa nii, et õhuavad oleksid vabad.
Suunake inhalaator neelu tagaseinale.
•Hingates aeglaselt ja sügavalt suu kaudu sisse, VAJUTAGE annustamisnupule ning jätkake aeglast sissehingamist niikaua kui see teile mugav tundub.
•Hoidke hinge kinni 10 sekundit või niikaua, kui see teile mugav tundub.
•Korrake keeramist, avamist ja vajutamist kokku 2 pihustuse puhul.
•Sulgege kaas kuni inhalaatori järgmise kasutamiseni.
4.3Vastunäidustused
Ülitundlikkus tiotroopiumi või olodaterooli või lõigus 6.1 loetletud mis tahes abiainete suhtes.
Ülitundlikkus atropiini või selle derivaatide, nt ipratroopiumi või oksütroopiumi suhtes.
4.4Erihoiatused ja ettevaatusabinõud kasutamisel
Astma
Yanimo Respimati ei tohi astma korral kasutada. Yanimo Respimati efektiivsust ja ohutust ei ole astma puhul uuritud.
Mitte ägedate episoodide raviks
Yanimo Respimat ei ole näidustatud bronhospasmi ägedate episoodide raviks, st erakorraliseks raviks.
Paradoksaalne bronhospasm
Nagu teiste inhaleeritavate ravimitega, võib ka Yanimo Respimati puhul tekkida paradoksaalne bronhospasm, mis võib olla eluohtlik. Paradoksaalse bronhospasmi tekkimisel tuleb Yanimo Respimati kasutamine otsekohe lõpetada ning asendada alternatiivse raviga.
Tiotroopiumiga seotud antikolinergilised toimed
Suletudnurga glaukoom, eesnäärme hüperplaasia või kusepõiekaela obstruktsioon
Seoses tiotroopiumi antikolinergilise aktiivsusega tuleb Yanimo Respimati kasutada ettevaatusega patsientidel, kellel esineb suletudnurga glaukoom, eesnäärme hüperplaasia või kusepõiekaela obstruktsioon.
Silma sümptomid
Patsiente tuleb hoiatada inhalatsioonilahuse silma sattumise eest. Neile tuleb seletada, et selle tagajärjeks võib olla suletudnurga glaukoomi teke või ägenemine, valu või ebamugavustunne silmas, ajutine nägemise hägunemine, sähvatused või värvilised kujutised nägemisel koos sidekesta kongestioonist tingitud silmade punetusega ja sarvkesta turse. Kui peaks tekkima mingi kombinatsioon nendest silma sümptomitest, peab patsient lõpetama Yanimo Respimati kasutamise ja konsulteerima koheselt spetsialistiga.
Hambakaaries
Suukuivus, mida on täheldatud antikolinergilise ravi puhul, võib pikaajalisel kasutamisel põhjustada hambakaariest.
Neerukahjustusega patsiendid
Kuna mõõduka kuni raske neerukahjustusega (kreatiniini kliirens ≤ 50 ml/min) patsientidel esinev neerufunktsiooni vähenemine suurendab tiotroopiumi kontsentratsiooni plasmas, tohib Yanimo Respimati kasutada ainult juhul, kui loodetav kasu on suurem kui võimalik risk. Raske neerukahjustusega patsientidega puudub pikaajaline kogemus (vt lõik 5.2).
Kardiovaskulaarsed toimed
Kuna kliinilistesse uuringutesse ei kaasatud patsiente, kellel oli eelmisel aastal olnud müokardiinfarkt, ebastabiilne või eluohtlik südamearütmia, kes olid eelmisel aastal hospitaliseeritud südamepuudulikkuse tõttu või paroksüsmaalse tahhükardia (> 100 lööki/min) diagnoosiga, on andmed Yanimo Respimati kohta neil patsientidel piiratud. Neil patsientidel tuleb Yanimo Respimati kasutada ettevaatusega.
Nagu teised
Pikatoimelisi
krambihäired või türeotoksikoos, teadaolev või võimalik QT intervalli pikenemine (nt QT> 0,44 s), ja sümpatomimeetilistele amiinidele ebatavaliselt tundlikel patsientidel.
Hüpokaleemia
Mõnel patsiendil võivad
Hüperglükeemia
Anesteesia
Plaanilisel operatsioonil halogeniseeritud süsivesinikanesteetikumidega tuleb olla ettevaatlik, kuna suureneb tundlikkus
Yanimo Respimati ei tohi kasutada koos ühegi teise pikatoimelisi
Patsiente, kes on regulaarselt (nt neli korda ööpäevas) kasutanud inhaleeritavaid lühitoimelisi beeta- adrenergiliste retseptorite agoniste, tuleb õpetada neid kasutama ainult ägedate respiratoorsete sümptomite leevendamiseks.
Yanimo Respimati ei tohi kasutada sagedamini kui üks kord ööpäevas.
Ülitundlikkus
Nagu kõigi ravimite puhul, võib ka pärast Yanimo Respimati manustamist esineda kohene ülitundlikkusreaktsioon.
4.5Koostoimed teiste ravimitega ja muud koostoimed
Ehkki Yanimo Respimati ja teiste ravimite kohta ei ole formaalseid in vivo ravimkoostoime uuringuid läbi viidud, on inhaleeritavat Yanimo Respimati kasutatud samaaegselt teiste KOK’i ravimite, sh lühitoimeliste sümpatomimeetiliste bronhodilataatorite ja inhaleeritavate kortikosteroididega, ilma et oleks saadud kliinilisi tõendeid ravimkoostoimete kohta.
Antikolinergilised ained
Yanimo Respimati ühe komponendi, tiotroopiumbromiidi, koosmanustamist teiste antikolinergilisi aineid sisaldavate ravimitega ei ole uuritud ning seetõttu ei soovitata.
Adrenergilised ained
Samaaegne teiste adrenergiliste ravimite manustamine (üksikult või kombineeritud ravi osana) võib võimendada Yanimo Respimati kõrvaltoimeid.
Ksantiini derivaadid, steroidid või diureetikumid
Samaaegne ravi ksantiini derivaatide, steroidide või kaaliumi mittesäästvate diureetikumidega võib võimendada adrenergiliste retseptorite agonistide igasuguseid hüpokaleemilisi toimeid (vt lõik 4.4).
Beetablokaatorid
Beetaadrenergiliste retseptorite blokaatorid võivad nõrgendada olodaterooli toimet või olla selle antagonistiks. Tuleb kaalutleda kardioselektiivse toimega beetablokaatorite kasutamist, ehkki neid tuleb manustada ettevaatusega.
MAO inhibiitorid ja tritsüklilised antidepressandid, QTc intervalli pikendavad ravimid
Monoaminooksüdaasi inhibiitorid, tritsüklilised antidepressandid ja teised teadaolevalt QTc intervalli pikendavad ravimid võivad tugevdada Yanimo Respimati toimet kardiovaskulaarsüsteemile.
Farmakokineetilised ravimkoostoimed
Ravimkoostoime uuringutes, milles manustati samaaegselt flukonasooli kui CYP2C9 inhibiitorit, ei tuvastatud olulist toimet olodaterooli plasmakontsentratsioonile.
Ketokonasooli, kui tugeva
In vitro uuringud on näidanud, et olodaterool ei inhibeeri kliinilises praktikas saavutatavate plasmakontsentratsioonide korral CYP3A4 ensüüme ega transportvalke.
4.6Fertiilsus, rasedus ja imetamine
Rasedus
Tiotroopium
Tiotroopiumi kasutamise kohta rasedatel on andmed väga piiratud. Loomkatsed ei ole näidanud kliiniliselt oluliste annuste puhul otsest ega kaudset kahjulikku toimet reproduktiivsusele (vt lõik 5.3).
Olodaterool
Puuduvad kliinilised andmed olodaterooli toime kohta rasedusele. Olodaterooli mittekliinilised andmed näitasid mitmekordsete raviannuste puhul toimeid, mis on tüüpilised
Ettevaatusmeetmena on eelistatav Yanimo Respimati kasutamist raseduse ajal vältida.
Nagu teised
Imetamine
Puuduvad kliinilised andmed tiotroopiumi ja/või olodaterooli kasutavate imetavate naiste kohta.
Nii tiotroopiumi kui olodaterooli loomuuringutes on imetavate rottide piimas avastatud neid aineid ja/või nende metaboliite, kuid ei ole teada, kas tiotroopium ja/või olodaterool eritub inimese rinnapiima.
Otsus imetamise jätkamise/lõpetamise või Yanimo Respimat ravi jätkamise/lõpetamise kohta tuleb vastu võtta, arvestades imetamise kasu lapsele ja Yanimo Respimat ravi kasu emale.
Fertiilsus
Tiotroopiumi ja olodaterooli või mõlema komponendi kombinatsiooni viljakust mõjutava toime kohta kliinilised andmed puuduvad. Eraldi komponentide tiotroopiumi ja olodaterooliga läbiviidud mittekliinilised uuringud ei näidanud mingeid kõrvaltoimeid viljakusele (vt lõik 5.3).
4.7Toime reaktsioonikiirusele
Ravimi toime kohta autojuhtimise ja masinate käsitsemise võimele ei ole uuringuid läbi viidud.
Siiski tuleb patsiente hoiatada, et Yanimo Respimati kasutamisel on täheldatud pearinglust ja nägemise hägustumist. Seega tuleb soovitada ettevaatust autojuhtimisel või masinate käsitsemisel. Kui patsientidel esinevad sellised sümptomid, peavad nad vältima potentsiaalselt ohtlikke tegevusi, nagu autojuhtimine või masinate käsitsemine.
4.8Kõrvaltoimed
a.Ohutusprofiili kokkuvõte
Paljud loetletud kõrvaltoimed võib omistada Yanimo Respimati komponentide tiotroopiumbromiidi antikolinergilistele omadustele või olodaterooli
b.Kõrvaltoimete kokkuvõte tabelina
Allpool loetletud kõrvaltoimetele omistatavad esinemissagedused põhinevad soovimatute ravimreaktsioonide (st Yanimo Respimatile omistatavate juhtumite) töötlemata esinemismääradel, mida täheldati annuse tiotroopium 5 mikrogrammi/olodaterool 5 mikrogrammi rühmas (1707 patsienti), mis olid kogutud KOK patsientide seitsmest aktiivse või platseebokontrolliga paralleelrühmadega kliinilisest uuringust, kus raviperioodid jäid vahemikku 4...52 nädalat.
Kõigis Yanimo Respimatiga läbiviidud kliinilistes uuringutes tuvastatud kõrvaltoimed on esitatud allpool vastavalt organsüsteemi klassile.
Need hõlmavad ka kõiki kõrvaltoimeid, mida on varem täheldatud kummagi komponendi puhul.
Esinemissagedus on defineeritud järgneva tava kohaselt:
Väga sage (≥ 1/10); sage (≥ 1/100 kuni < 1/10);
Organsüsteemi klass |
Kõrvaltoime |
Esinemissagedus |
Infektsioonid ja infestatsioonid |
Nasofarüngiit |
Harv |
Ainevahetus- ja toitumishäired |
Dehüdratsioon |
Teadmata |
Närvisüsteemi häired |
Pearinglus |
|
|
Unetus |
|
|
Peavalu |
|
Silma kahjustused |
Hägune nägemine |
Harv |
|
Glaukoom |
Teadmata |
|
Silmasisese rõhu tõus |
Teadmata |
Südame häired |
Kodade fibrillatsioon |
|
|
Tahhükardia |
|
|
Südamepekslemine |
|
|
Supraventrikulaarne tahhükardia |
Harv |
Vaskulaarsed häired |
Hüpertensioon |
|
Respiratoorsed, rindkere ja |
Köha |
|
mediastiinumi häired |
Düsfoonia |
|
|
Larüngiit |
Harv |
|
Farüngiit |
Harv |
|
Ninaverejooks |
Harv |
|
Bronhospasm |
Teadmata |
|
Sinusiit |
Teadmata |
Seedetrakti häired |
Suukuivus |
Sage |
|
Kõhukinnisus |
|
|
Orofarüngeaalne kandidiaas |
Harv |
|
Gingiviit |
Harv |
|
Iiveldus |
Harv |
|
Soolestiku obstruktsioon |
Teadmata |
|
Paralüütiline iileus |
|
|
Düsfaagia |
Teadmata |
|
Gastroösofageaalne reflukshaigus |
Teadmata |
|
Glossiit |
Teadmata |
|
Stomatiit |
Teadmata |
|
Hambakaaries |
Teadmata |
Naha ja nahaaluskoe kahjustused, |
Ülitundlikkus |
Harv |
immuunsüsteemi häired |
Angioödeem |
Harv |
|
|

|
Urtikaaria |
Harv |
|
Sügelus |
Harv |
|
Anafülaktiline reaktsioon |
Teadmata |
|
Lööve |
Teadmata |
|
Nahainfektsioon ja nahahaavand |
Teadmata |
|
Kuiv nahk |
Teadmata |
Liigesevalu |
Harv |
|
kahjustused |
Seljavalu |
Harv |
|
Liigeste turse |
Teadmata |
Neerude ja kuseteede häired |
Kusepeetus |
Harv |
|
Kuseteede infektsioon |
Harv |
|
Düsuuria |
Harv |
1 kõrvaltoimed, mida on täheldatud Yanimo Respimatiga, kuid mitte kummagi komponendiga eraldi
c.Valitud kõrvaltoimete kirjeldus
Yanimo Respimatis on kombineeritud tema komponentide tiotroopiumi ja olodaterooli antikolinergilised ja
Antikolinergiliste kõrvaltoimete profiil
Yanimo Respimatiga läbiviidud pikaajalises,
Tõsisteks kõrvaltoimeteks, mis on kooskõlas antikolinergiliste toimetega, olid glaukoom, kõhukinnisus, sooleobstruktsioon, sh paralüütiline iileus ja kusepeetus.
Yanimo Respimatiga läbiviidud pikaajalises,
Yanimo Respimati üks komponent olodaterool kuulub pikatoimeliste
d.Patsientide erirühmad
Mida kõrgem vanus, seda enam võivad esineda antikolinergilised toimed.
Võimalikest kõrvaltoimetest teavitamine
Ravimi võimalikest kõrvaltoimetest on oluline teavitada ka pärast ravimi müügiloa väljastamist. See võimaldab jätkuvalt hinnata ravimi kasu/riski suhet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest kõrvaltoimetest www.ravimiamet.ee kaudu.
4.9Üleannustamine
Teave Yanimo Respimati üleannustamise kohta on piiratud. Yanimo Respimati on uuritud annustes kuni 5 mikrogrammi/10 mikrogrammi (tiotroopium/olodaterool) KOK patsientidel ning kuni 10 mikrogrammi/40 mikrogrammi (tiotroopium/olodaterool) tervetel inimestel. Kliiniliselt olulisi kõrvaltoimeid ei täheldatud. Üleannus võib esile kutsuda tiotroopiumi liialdatud muskariiniretseptoreid blokeerivaid toimeid ja/või olodaterooli liialdatud
Sümptomid
Antikolinergikum tiotroopiumi üleannus
Tiotroopiumi suured annused võivad põhjustada antikolinergilisi sümptomeid.
Siiski ei täheldatud tervetel vabatahtlikel pärast kuni 340 mikrogrammi tiotroopiumbromiidi üksikannuse inhaleerimist mingeid süsteemseid antikolinergilisi kõrvaltoimeid. Pealegi ei täheldatud tervetel vabatahtlikel pärast kuni 40 mikrogrammi tiotroopiumi inhalatsioonilahuse annustamist
14 päeva jooksul mingeid olulisi kõrvaltoimeid peale suu/kurgukuivuse ja nina limaskesta kuivuse, välja arvatud selgelt väljendunud süljeerituse vähenemine alates
Olodaterooli üleannus põhjustab tõenäoliselt
Üleannustamise ravi
Ravi Yanimo Respimatiga tuleb lõpetada. Näidustatud on toetav ja sümptomaatiline ravi. Tõsistel juhtudel tuleb patsiendid hospitaliseerida. Võib kaalutleda kardioselektiivsete
5.FARMAKOLOOGILISED OMADUSED
5.1Farmakodünaamilised omadused
Farmakoterapeutiline rühm:
Hingamisteede obstruktiivsete haiguste raviks kasutatavad ained, adrenergilised ained kombinatsioonis antikolinergiliste ainetega
Toimemehhanism
Yanimo Respimat
Yanimo Respimat on fikseeritud annusekombinatsiooniga inhalatsioonilahus, mis sisaldab pikatoimelist muskariiniretseptorite antagonisti tiotroopiumi ja pikatoimelist
Seoses oma erineva toimimisviisiga kutsuvad need kaks toimeainet esile summeerunud bronhodilatsiooni. Kuna muskariiniretseptorid näivad olevat ülekaalus tsentraalsetes hingamisteedes, samas kui
Tiotroopium
Tiotroopiumbromiid on pikatoimeline muskariiniretseptorite spetsiifiline antagonist. Ta omab sarnast afiinsust alatüüpide M1 kuni M5 suhtes. Hingamisteedes seondub tiotroopiumbromiid konkureerivalt ja pöörduvalt bronhide silelihaste M3 retseptoritega, olles antagonistiks atsetüülkoliini kolinergilistele (bronhokonstriktiivsetele) toimetele, mille tulemuseks on bronhide silelihaste lõõgastumine. See toime sõltub annuse suurusest ja kestab kauem kui 24 tundi.
Olodaterool
Olodaterool omab kõrget afiinsust ja selektiivsust inimese
In vitro uuringud on näidanud, et olodaterool omab
Farmakoloogiline toime avaldub
Nende retseptorite aktiveerumisega hingamisteedes kaasneb tsüklilise
Olodateroolil on pikatoimelise selektiivse
Toimed südame elektrofüsioloogiale
Tiotroopium
Sihtotstarbelises QT uuringus, millesse oli kaasatud 53 tervet vabatahtlikku, manustati 12 päeva jooksul 18 mikrogrammi ja 54 mikrogrammi (st kolmekordne raviannus) tiotroopiumi inhalatsioonipulbrit, mis ei pikendanud oluliselt QT intervalli
Olodaterool
Topeltpimedas, randomiseeritud, platseebo- ja võrdlusravimi (moksifloksatsiin) kontrolliga uuringus
Yanimo Respimat
Kahte
Kliiniline efektiivsus ja ohutus
Yanimo Respimati 3. faasi kliiniline arendusprogramm hõlmas kolme randomiseeritud, topeltpimedat uuringut:
(i)kaht
5 mikrogrammi tiotroopiumi ja 5 mikrogrammi olodaterooliga (1 029 patsienti said Yanimo Respimati) [uuringud 1 ja 2]
(ii)üht
Neis uuringutes manustati võrdluspreparaate 5 mikrogrammi tiotroopiumi, 5 mikrogrammi olodaterooli ja platseebot Respimat inhalaatori kaudu.
Patsientide üldiseloomustus
Enamus
Toimed kopsufunktsioonile
Mõlemas uuringus täheldati 24 nädala pärast olulisi paranemisi
Tabel 1 Yanimo Respimati
|
|
|
FEV1 |
|
|
Minimaalse FEV1 vastus |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Uuring 1 |
|
Uuring 2 |
|
Uuring 1 |
|
Uuring 2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
Keskmine |
n |
|
Keskmine |
n |
|
Keskmine |
n |
|
Keskmine |
|
|
|
|
|
|
|
|
|
|
|
|
|
Yanimo Respimat |
|
|
|
|
||||||||
VERSUS |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tiotroopium 5 |
|
0,117 l |
|
0,103 l |
|
0,071 l |
|
0,050 l |
||||
mikrogrammi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Olodaterool 5 |
|
0,123 l |
|
0,132 l |
|
0,082 l |
|
0,088 l |
||||
mikrogrammi |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ravieelne FEV1 algväärtus: uuring 1 = 1,16 l; uuring 2 = 1,15 l p≤0,0001 kõigi võrdluste puhul
n = patsientide arv
Patsientidel, kel esines ravi alguses kõrgem reversiivsuse aste, täheldati Yanimo Respimatiga üldiselt tugevamat bronhodilateerivat vastust kui ravi alguses madalama reversiivsuse astmega patsientidel.
Yanimo Respimati tugevamad bronhodilatoorsed toimed, võrreldes 5 mikrogrammi tiotroopiumi ja 5 mikrogrammi olodaterooliga, püsisid kogu
parandas ka hommikust ja õhtust PEFR’i (ekspiratoorse tippvoolu kiirus), võrreldes 5 mikrogrammi tiotroopiumi ja 5 mikrogrammi olodaterooliga, mõõdetuna patsiendi igapäevaste üleskirjutuste järgi.
Tabel 2 Keskmine FEV1 erinevus (l) 3, 12 ja 24 tunni jooksul ning minimaalse FEV1 erinevus (l) Yanimo Respimati puhul, võrreldes 5 mikrogrammi tiotroopiumi, 5 mikrogrammi olodaterooli ja platseeboga, 6 nädala pärast (uuring 3)
|
n |
3 tunni |
n |
12 tunni |
24 tunni |
Minimaalne |
|
|
keskmine |
|
keskmine |
keskmine |
|
Yanimo Respimat |
|
|
|
|
||
VERSUS |
|
|
|
|
|
|
|
|
|
|
|
|
|
Tiotroopium 5 |
0,109 |
0,119 |
0,110 |
0,079 |
||
mikrogrammi |
|
|
|
|
|
|
Olodaterool 5 |
0,109 |
0,126 |
0,115 |
0,092 |
||
mikrogrammi |
|
|
|
|
|
|
Platseebo |
0,325 |
0,319 |
0,280 |
0,207 |
||
|
|
|
|
|
|
|
ravieelne FEV1 algväärtus = 1,30 l 1 esmane tulemusnäitaja p<0,0001 kõigi võrdluste puhul
n = patsientide arv
Tervisega seotud elukvaliteet
Yanimo Respimati puhul ilmnes tervisega seotud elukvaliteedi paranemine, mida näitas St. George’i respiratoorsete haiguste küsimustiku (St. George Respiratory Questionnaire, SGRQ) üldskoori vähenemine. 24 nädala pärast täheldati Yanimo Respimati puhul statistiliselt olulist keskmise SGRQ üldskoori paranemist, võrreldes 5 mikrogrammi tiotroopiumi ja 5 mikrogrammi olodaterooliga (tabel 3), kusjuures paranemised esinesid kõigis SGRQ valdkondades. SGRQ üldskoori kliiniliselt tähendusrikas paranemine (MCID/minimaalne kliiniliselt oluline erinevus), defineeritud kui vähemalt
Tabel 3 SGRQ üldskoor pärast 24 ravinädalat
|
|
|
Ravi keskmine |
Erinevus Yanimo |
|
|
n |
(muutus |
Respimatist |
|
|
|
algväärtusest) |
Keskmine |
Üldskoor |
Algväärtus |
|
43.5 |
|
|
Yanimo Respimat |
36,7 |
|
|
|
Tiotroopium 5 |
37,9 |
||
|
mikrogrammi |
|
|
|
|
Olodaterool 5 |
38,4 |
||
|
mikrogrammi |
|
|
|
n = patsientide arv |
|
|
|
|
Kahes täiendavas
SGRQ üldskoori kliiniliselt olulise langusega patsientide proportsioon (määratletud kui langus algväärtusest vähemalt 4 ühikut) 12 nädala pärast Yanimo Respimati puhul suurem (52% [206/393]) kui 5 mikrogrammi tiotroopiumi puhul (41% [159/384]; šansside suhe: 1,56 (95% CI: 1,17; 2,07),
p = 0,0022) ja platseebo (32% [118/370]; šansside suhe: 2,35 (95% CI: 1,75; 3,16), p <0,0001).
Düspnoe
24 nädala pärast oli Yanimo Respimati keskmine TDI (ülemineku/mööduva düspnoe indeksi) keskne skoor 1,98 ühikut, mis oli oluline paranemine, võrreldes 5 mikrogrammi tiotroopiumi (keskmine erinevus 0,36, p=0,008) ja 5 mikrogrammi olodaterooliga (keskmine erinevus 0,42, p=0,002).
TDI keskse skoori kliiniliselt tähendusrikas paranemine (MCID, defineeritud kui vähemalt
Erakorraliste ravimite kasutamine
Yanimo Respimatiga ravitud patsiendid kasutasid päevasel ja öisel ajal vähem erakorralist salbutamooli, võrreldes patsientidega, keda raviti 5 mikrogrammi tiotroopiumi ja 5 mikrogrammi olodaterooliga (keskmine erakorralise ravimi kasutamine päevasel ajal oli Yanimo Respimati puhul 0,76 juhtumit ööpäevas, võrreldes 0,97 juhtumiga ööpäevas 5 mikrogrammi tiotroopiumi puhul ja 0,87 juhtumiga ööpäevas 5 mikrogrammi olodaterooli puhul, p<0,0001; keskmine erakorralise ravimi kasutamine öisel ajal oli Yanimo Respimati puhul 1,24 juhtumit ööpäevas, võrreldes 1,69 juhtumiga ööpäevas 5 mikrogrammi tiotroopiumi puhul ja 1,52 juhtumiga ööpäevas 5 mikrogrammi olodaterooli puhul, p<0,0001).
Patsientide globaalne hinnang
Yanimo Respimatiga ravitud patsiendid tajusid oma respiratoorse seisundi olulisemat paranemist, võrreldes 5 mikrogrammi tiotroopiumi ja 5 mikrogrammi olodaterooli saanud patsientidega, mida mõõdeti patsiendi globaalse hinnangu (PGR) skaala alusel.
Ägenemised
5 mikrogrammi tiotroopiumiga on eelnevalt tõestatud statistiliselt oluline KOK’i ägenemise riski vähenemine, võrreldes platseeboga. KOK ägenemised olid täiendava tulemusnäitajana lülitatud 52- nädalastesse kesksetesse uuringutesse (uuringud 1 ja 2). Kombineeritud andmekogumik näitab, et Yanimo Respimati puhul on vähemalt üht KOK mõõdukat/rasket ägenemist kogenud patsientide proportsioon 27,7% ja 5 mikrogrammi tiotroopiumi puhul 28,8% (p=0,39). Need uuringud ei olnud spetsiifiliselt kavandatud hindamaks ravide toimeid KOK ägenemistele.
Sissehingamismaht, hingamisraskus ja koormustaluvus
Yanimo Respimati toimet sissehingamismahule, hingamisraskusele ja sümptomite poolt limiteeritud koormustaluvusele uuriti KOK patsientidel kolmes randomiseeritud, topeltpimedas uuringus:
(i)kahes
(ii)ühes
Yanimo Respimati puhul täheldati 6 nädala pärast oluliselt paremat rahuoleku sissehingamismahtu kaks tundi pärast annustamist, võrreldes 5 mikrogrammi tiotroopiumi (0,114 l, p<0,0001; uuring 4, 0,088 l, p=0,0005; uuring 5), 5 mikrogrammi olodaterooli (0,119 l, p<0,0001; uuring 4, 0,080, p=0,0015; uuring 5) ja platseeboga (0,244 l, p<0,0001; uuring 4, 0,265, p<0,0001; uuring 5).
Uuringutes 4 ja 5 täheldati Yanimo Respimati puhul 6 nädala pärast oluliselt paremat koormustaluvuse aega püsiva koormusega veloergomeetrial kui platseebo puhul (uuring 4: koormustaluvuse aja geomeetriline keskmine Yanimo Respimati puhul 454 sekundit ja platseebo puhul 375 sekundit (20,9% paremus, p<0,0001); uuring 5: koormustaluvuse aja geomeetriline keskmine Yanimo Respimati puhul 466 sekundit ja platseebo puhul 411 sekundit (13,4% paremus, p<0,0001)).
Uuringus 6 täheldati Yanimo Respimati puhul 12 nädala pärast oluliselt paremat koormustaluvuse aega püsiva koormusega veloergomeetrial kui platseebo puhul (koormustaluvuse aja geomeetriline keskmine Yanimo Respimati puhul 528 sekundit ja platseebo puhul 464 sekundit (13,8% paremus, p<0,021).
Lapsed
Euroopa Ravimiamet ei kohusta esitama Yanimo Respimatiga läbi viidud uuringute tulemusi laste kõikide alarühmade kohta kroonilise obstruktiivse kopsuhaiguse (KOK) korral (teave lastel kasutamise kohta: vt lõik 4.2).
5.2Farmakokineetilised omadused
a.Üldtutvustus
Tiotroopiumi ja olodaterooli manustamisel kombinatsioonina inhalatsiooni teel olid mõlema komponendi farmakokineetilised parameetrid sarnased kummagi toimeaine eraldi manustamisel täheldatule.
Tiotroopiumi ja olodaterooli farmakokineetika on terapeutilises vahemikus lineaarne. Korduval manustamisel inhalatsioonina üks kord ööpäevas saabub tiotroopiumi tasakaalukontsentratsioon 7. päevaks. Olodaterooli tasakaalukontsentratsioon saabub 8 päeva pärast inhalatsioone üks kord ööpäevas ning kumulatsioon on ühekordse annusega võrreldes
b.Toimeaine üldiseloomustus pärast ravimi manustamist
Imendumine
Tiotroopium: Pärast lahuse inhaleerimist RESPIMAT inhalaatori kaudu noorte tervete vabatahtlike poolt on andmed uriiniga eritumise kohta näidanud, et ligikaudu 33% inhaleeritud annusest jõuab süsteemsesse ringesse. Suukaudsete lahuste absoluutne biosaadavus on 2…3%. Tiotroopiumi maksimaalseid plasmakontsentratsioone täheldatakse 5...7 minutit pärast RESPIMATi kaudu inhaleerimist.
Olodaterool: Tervetel vabatahtlikel oli olodaterooli absoluutne biosaadavus pärast inhalatsiooni hinnanguliselt ligikaudu 30%, kusjuures pärast suukaudse lahuse manustamist oli see alla 1%. Olodaterooli maksimaalne kontsentratsioon plasmas saabub tavaliselt 10...20 minuti jooksul pärast ravimi inhaleerimist RESPIMATi kaudu.
Jaotumine
Tiotroopium seondub 72% ulatuses plasmavalkudega ja tema jaotusruumala on 32 l/kg. Rottidega läbiviidud uuringud on näidanud, et tiotroopium ei läbi olulisel määral hematoentsefaalbarjääri.
Olodaterool seondub ligikaudu 60% ulatuses plasmavalkudega ning tema jaotusruumala on 1 110 l. Olodaterool on
Biotransformatsioon
Tiotroopium: Metabolism on väikese ulatusega. Seda kinnitab leid, et uriiniga eritub 74% ainest esialgsel kujul pärast veenisisest manustamist. Ester tiotroopium lõhustub mitteensümaatilisel teel alkoholiks ja happeliseks ühendiks (vastavalt
Olodaterool metaboliseerub olulisel määral otsese glükuroniseerumise ja metoksüülrühma O- demetüleerumise kaudu, millele järgneb konjugeerumine. Kuuest tuvastatud metaboliidist seondub
Eritumine
Tiotroopium: Totaalne kliirens tervetel vabatahtlikel on 880 ml/min. Veenisiseselt manustatud tiotroopium eritub peamiselt muutumatult uriiniga (74%). Pärast inhaleerimist KOK patsientide poolt kuni tasakaalukontsentratsioonini eritub uriiniga 18,6% annusest, kusjuures ülejäänu paikneb peamiselt imendumata ravimina sooles ning elimineerub väljaheitega. Tiotroopiumi renaalne kliirens ületab glomerulaarfiltratsiooni kiiruse, mis näitab aktiivset eritumist uriini. Tiotroopiumi efektiivne poolväärtusaeg KOK patsientidel pärast inhalatsiooni on vahemikus 27...45 tundi.
Olodaterool: Tervetel vabatahtlikel on olodaterooli totaalne kliirens 872 ml/min ja renaalne kliirens 173 ml/min. Pärast
c.Patsientide iseloomustus
Tiotroopium: Nagu on oodata kõigi peamiselt renaalselt erituvate ravimite puhul, kaasnes kõrge eaga tiotroopiumi renaalse kliirensi vähenemine KOK patsientidel 346 ml/min (< 65 eluaasta) kuni
275 ml/min (≥ 65 eluaasta). See ei põhjustanud vastavaid
Olodaterool: Farmakokineetiline
Rass
Olodaterool: Farmakokineetiliste andmete võrdlus uuringus ja uuringute lõikes näitas, et jaapanlastel ja teistel aasialastel oli olodaterooli plasmakontsentratsioon suurem kui europiidsel populatsioonil. Europiidse ja aasia populatsiooniga läbiviidud kuni
Neerupuudulikkus
Tiotroopium: Tiotroopiumi manustamisega kerge neerukahjustusega (CLCR 50...80 ml/min) KOK patsientidele inhalatsiooni teel üks kord ööpäevas kuni tasakaalukontsentratsiooni saavutamiseni kaasnes veidi suurem
Olodaterool: Neerukahjustusega patsientidel ei esinenud kliiniliselt olulist süsteemselt ringleva aine koguse suurenemist.
Maksapuudulikkus
Tiotroopium: Maksapuudulikkus ei avalda arvatavasti mingit olulist mõju tiotroopiumi farmakokineetikale. Tiotroopium puhastub organismist eeskätt renaalse eliminatsiooni teel (74% noortel tervetel vabatahtlikel) ja estri lihtsa mitteensümaatilise lõhustumise kaudu farmakoloogilise toimeta jääkideks.
Olodaterool: Kerge või mõõduka maksakahjustusega patsientide ja tervete kontrollisikute vahel ei esinenud erinevust olodaterooli eliminatsioonis ega valguseonduvuses. Raske maksakahjustusega patsientidel ei ole uuringuid teostatud.
5.3Prekliinilised ohutusandmed
Tiotroopium + olodaterool
Tiotroopiumi/olodaterooli kombinatsiooni mittekliinilistes uuringutes täheldati toimeid vaid soovitatud kliinilistest maksimaalsetest annustest tunduvalt suuremate annuste manustamisel, mis on kliinilises kasutuses väheoluline.
Tiotroopium
Genotoksilisuse ja kartsinogeense potentsiaali uuringud ei ole näidanud kahjulikku toimet inimesele. Tiinuse, embrüofetaalse arengu, poegimise või postnataalse arenguga seonduvaid kahjulikke toimeid võis tõestada ainult emale toksiliste annuste tasemel. Rottidel ja küülikutel ei osutunud tiotroopiumbromiid teratogeenseks. Respiratoorseid ja urogenitaalseid muutusi (vastavalt ärritus ja prostatiit) ning reproduktiivtoksilisust täheldati lokaalsete ja süsteemsete ekspositsioonide korral, mis ületasid rohkem kui
Olodaterool
Genotoksilisuse ja kartsinogeense potentsiaali uuringud ei ole näidanud kahjulikku toimet inimesele. Rottidel täheldati mesovariumi leiomüoomi ja hiirtel emaka leiomüoomi ja leiomüosarkoomi esinemissageduse tõusu. Seda peetakse ravimiklassi toimeks, mida täheldatakse närilistel pärast
Rottidel ei esinenud pärast annuste 1054 mikrogrammi/kg/ööpäevas inhaleerimist teratogeenseid toimeid (>
6.FARMATSEUTILISED ANDMED
6.1Abiainete loetelu
Bensalkooniumkloriid Dinaatriumedetaat Puhastatud vesi
1M vesinikkloriidhape (pH kohandamiseks)
6.2Sobimatus
Ei kohaldata.
6.3Kõlblikkusaeg
3 aastat
Kõlblikkusaeg pärast esimest kasutamist: 3 kuud
6.4Säilitamise eritingimused
Mitte lasta külmuda.
6.5Pakendi iseloomustus ja sisu
Ravimi sisepakendi tüüp ja materjal:
Lahus paikneb polüetüleenist/polüpropüleenist kolbampullis, millel on polüpropüleenkaas koos sellega ühendatud silikoonrõngaga. Kolbampull on suletud alumiiniumsilindriga.
Üks kolbampull sisaldab 4 ml inhalatsioonilahust.
Pakendi suurused ja kaasasolevad seadmed:
Üksikpakend: 1 Respimat inhalaator ja 1 kolbampull, milles sisaldub 60 pihustust (30 raviannust).
Kõik pakendi suurused ei pruugi olla müügil.
6.6Erihoiatused ravimpreparaadi hävitamiseks ja käsitlemiseks
Kasutamata ravimpreparaat või jäätmematerjal tuleb hävitada vastavalt kohalikele nõuetele.
7.MÜÜGILOA HOIDJA
Boehringer Ingelheim International GmbH
Binger Strasse 173
Saksamaa
8.MÜÜGILOA NUMBER
9.ESMASE MÜÜGILOA VÄLJASTAMISE/MÜÜGILOA UUENDAMISE KUUPÄEV
Müügiloa esmase väljastamise kuupäev: 02.07.2015
10.TEKSTI LÄBIVAATAMISE KUUPÄEV
mai 2017
