Striverdi respimat - inhalatsioonilahus (2,5mcg 1annust) - Ravimi omaduste kokkuvõte
Artikli sisukord

RAVIMI OMADUSTE KOKKUVÕTE
 Käesoleva ravimi suhtes kohaldatakse täiendavat järelevalvet, mis võimaldab kiiresti tuvastada uut ohutusteavet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest kõrvaltoimetest. Kõrvaltoimetest teavitamise kohta vt lõik 4.8.
Käesoleva ravimi suhtes kohaldatakse täiendavat järelevalvet, mis võimaldab kiiresti tuvastada uut ohutusteavet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest kõrvaltoimetest. Kõrvaltoimetest teavitamise kohta vt lõik 4.8.
1.RAVIMPREPARAADI NIMETUS
Striverdi Respimat, 2,5 mikrogrammi inhalatsioonilahus
2.KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS
Üks inhaleeritav annus sisaldab 2,5 mikrogrammi olodaterooli (vesinikkloriidina) ühe vajutuse kohta. Inhaleeritav annus on see annus, mis on pärast huuliku läbimist patsiendi poolt kasutatav.
INN. Olodaterolum.
Abiainete täielik loetelu vt lõik 6.1.
3.RAVIMVORM
Inhalatsioonilahus.
Selge, värvitu inhalatsioonilahus.
4.KLIINILISED ANDMED
4.1Näidustused
Bronhodilateeriv säilitusravi kroonilise obstruktiivse kopsuhaigusega (KOK) patsientidel.
4.2Annustamine ja manustamisviis
Annustamine
Ravim on mõeldud ainult inhalatsiooniks. Kolbampulli võib sisestada ainult Respimat inhalaatorisse ja kasutada vaid sellega.
Üks raviannus koosneb kahest Respimat inhalaatori pihustusannusest.
Täiskasvanud
Soovitatav annus on 5 mikrogrammi olodaterooli, manustades kaks Respimat inhalaatori pihustusannust üks kord ööpäevas, iga päev samal ajal.
Soovitatavat annust ei tohi ületada.
Eakad
Eakad patsiendid võivad kasutada Striverdi Respimat’i soovitatud annuses.
Maksakahjustus
Kerge ja mõõduka maksakahjustusega patsiendid võivad kasutada Striverdi Respimat’i soovitatud annuses.
Striverdi Respimat’i kasutamise kohta raske maksakahjustusega patsientidel andmed puuduvad.
Neerukahjustus
Neerukahjustusega patsiendid võivad kasutada Striverdi Respimat’i soovitatud annuses. Striverdi Respimat’i kasutamise kohta raske neerukahjustusega patsientidel on andmed piiratud.
Lapsed
Puudub Striverdi Respimat’i asjakohane kasutus lastel (alla 18 eluaasta).
Manustamisviis
Ravimi õige manustamise tagamiseks peab arst või mõni muu meditsiinitöötaja patsiendile näitama, kuidas inhalaatorit kasutada.
Kasutusjuhend
Sissejuhatus
Striverdi Respimat (olodaterool). Enne Striverdi Respimat’i kasutamist lugege seda kasutusjuhendit.
Teil on vaja seda inhalaatorit kasutada ainult ÜKS KORD ÖÖPÄEVAS. Iga kord, kui te ravimit kasutate, manustage KAKS PIHUSTUST.
•Kui Striverdi Respimat’i ei ole kasutatud üle 7 päeva, siis pihustage üks pihustus suunaga allapoole.
•Kui Striverdi Respimat’i ei ole kasutatud üle 21 päeva, siis korrake lõigus „Esmakordseks kasutamiseks ettevalmistamine“ kirjeldatud etappe 4 kuni 6, kuni näete ravimipilve. Seejärel korrake etappe 4 kuni 6 veel kolm korda.
•Ärge puudutage augustuselementi läbipaistvas kattes.
Kuidas Striverdi Respimat’i hooldada
Puhastage huulikut ja temas paiknevat metallosa niiske lapi või pabersalvrätiga vähemalt üks kord nädalas.
Huuliku vähene värvuse muutus ei mõjuta Striverdi Respimat inhalaatori toimimist. Vajadusel puhastage Striverdi Repimat inhalaatori välispinda, pühkides niiske lapiga.
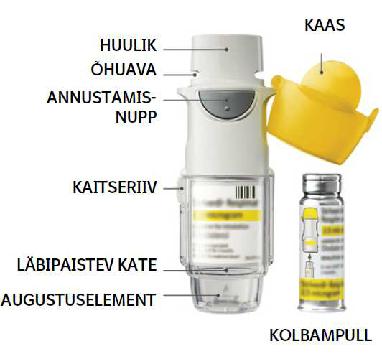
Millal võtta kasutusele uus Striverdi Respimat
•Striverdi Respimat inhalaator sisaldab 60 pihustust (30 annust), kui seda vastavalt annustamisjuhisele kasutada (kaks pihustust üks kord ööpäevas).
•Annuseindikaator näitab ligikaudu, kui palju ravimit on alles.
•Kui osuti jõuab skaala punasesse piirkonda, vajate te uut retsepti. Ravimit on jäänud ligikaudu 7 päevaks (14 pihustust).
•Kui annuseindikaator on jõudnud punase skaala lõppu, lukustub Striverdi Respimat inhalaator automaatselt – rohkem annuseid ei saa pihustada. Selles olukorras ei saa läbipaistvat katet enam keerata.
•Striverdi Respimat tuleb ära visata kolm kuud pärast selle ettevalmistamist esmakordseks kasutamiseks, isegi kui kogu ravim ei ole ära kasutatud või on täielikult kasutamata.
Esmakordseks kasutamiseks ettevalmistamine
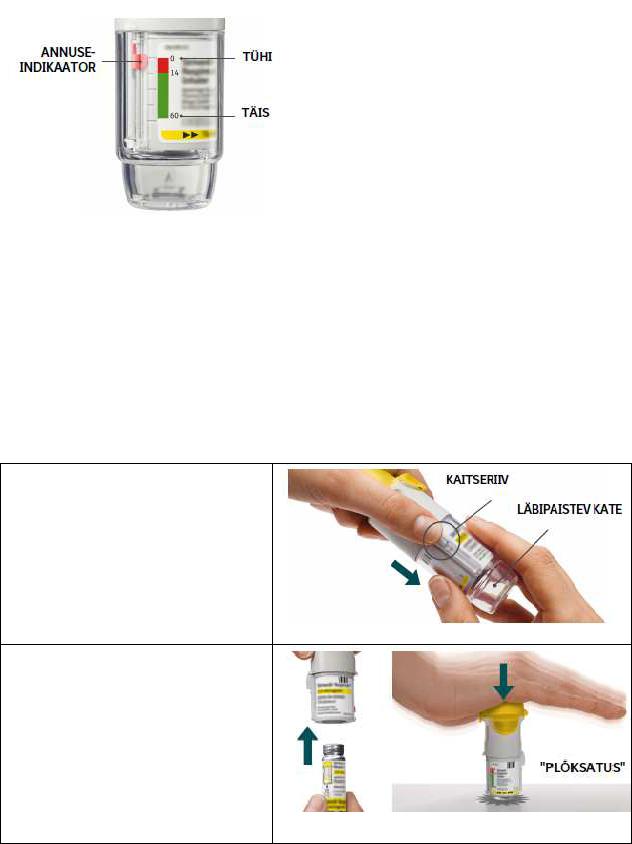
1.Eemaldage läbipaistev kate
• Hoidke kaas suletuna.
• Vajutage kaitseriivile, samal ajal teise käega läbipaistvat katet kindlalt ära tõmmates.
2.Sisestage kolbampull
•Sisestage kolbampulli kitsas ots inhalaatorisse.
•Asetage inhalaator kindlale pinnale ja vajutage kindlalt alla, kuni kolbampull plõksatab kohale.
•Ärge eemaldage kolbampulli, kui see on juba inhalaatorisse paigaldatud.
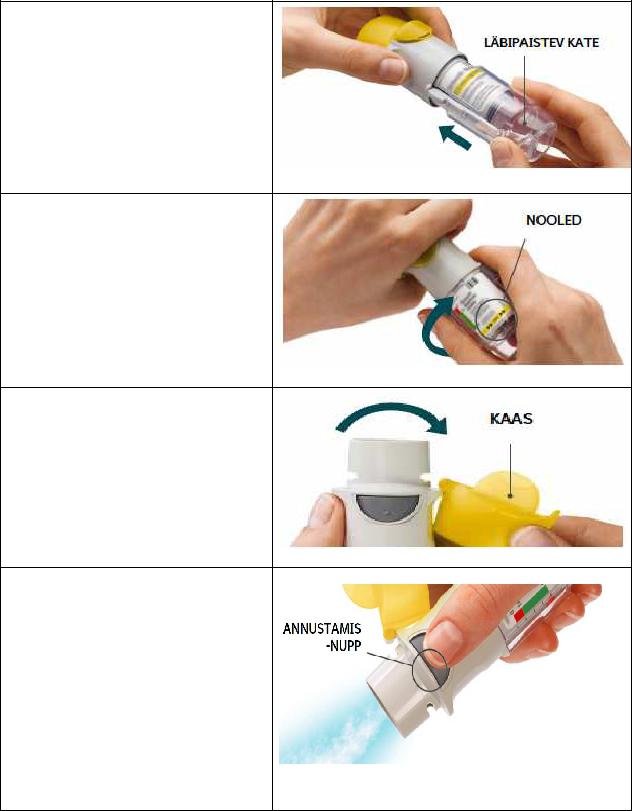
3.Paigutage läbipaistev kate tagasi
•Paigutage läbipaistev kate tagasi oma kohale, kuni see plõksatab.
•Ärge läbipaistvat katet seejärel enam eemaldage.
4.Keerake
•Hoidke kaas suletuna.
•Keerake läbipaistvat katet etiketil kujutatud nooltega märgistatud suunas, kuni see plõksatab (pool pööret).
5.Avage
•Avage kaas, nii et see plõksatab täiesti lahti.
6.Vajutage
•Suunake inhalaator otsaga allapoole.
•Vajutage annustamisnupule.
•Sulgege kaas.
•Korrake etappe 4 kuni 6, kuni näete ravimipilve.
•Pärast seda, kui näete ravimipilve, korrake etappe 4 kuni 6 veel kolm korda.
Teie inhalaator on nüüd kasutusvalmis. Need etapid ei mõjuta kättesaadavate annuste arvu. Pärast ettevalmistamist saab inhalaatorist väljutada 60 pihustust (30 raviannust).
Igapäevane kasutamine
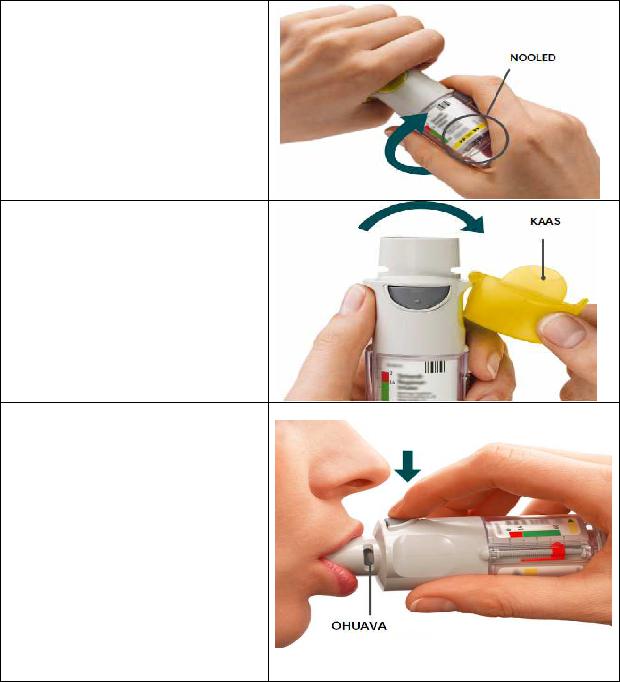
KEERAKE
•Hoidke kaas suletuna.
•KEERAKE läbipaistvat katet etiketil kujutatud nooltega märgistatud suunas, kuni see klõpsatab (pool pööret).
AVAGE
•AVAGE kaas, kuni see plõksatab täiesti lahti.
VAJUTAGE
•Hingake aeglaselt ja täielikult välja.
•Sulgege huuled ümber huuliku otsa nii, et õhuavad oleksid vabad. Suunake inhalaator neelu tagaseinale.
•Hingates aeglaselt ja sügavalt suu kaudu sisse, VAJUTAGE annustamisnupule ning jätkake aeglast sissehingamist niikaua, kui see teile mugav tundub
•Hoidke hinge kinni 10 sekundit või niikaua, kui see teile mugav tundub.
•Korrake keeramist, avamist ja vajutamist kokku 2 pihustuse puhul.
•Sulgege kaas kuni inhalaatori järgmise kasutamiseni.
4.3Vastunäidustused
Ülitundlikkus olodaterooli või lõigus 6.1 loetletud mis tahes abiainete suhtes.
4.4Erihoiatused ja ettevaatusabinõud kasutamisel
Astma
Striverdi Respimat’i ei tohi astma korral kasutada. Olodaterooli pikaajalist efektiivsust ja ohutust ei ole astma puhul uuritud.
Äge bronhospasm
Striverdi Respimat’i kui üks kord ööpäevas kasutatavat pikatoimelist bronhodilaatorit ei tohi kasutada ägedate bronhospasmi episoodide raviks, st erakorralise ravina.
Ülitundlikkus
Nagu kõigi ravimite puhul, võib kohe pärast Striverdi Respimat’i manustamist tekkida kohene ülitundlikkusreaktsioon.
Paradoksaalne bronhospasm
Nagu teiste inhaleeritavate ravimitega, võib ka Striverdi Respimat’i puhul tekkida paradoksaalne bronhospasm, mis võib olla eluohtlik. Paradoksaalse bronhospasmi tekkimisel tuleb Striverdi Respimat’i kasutamine otsekohe lõpetada ning asendada alternatiivse raviga.
Süsteemsed toimed
Pikatoimelisi
Kliinilistesse uuringutesse ei kaasatud patsiente, kel oli eelmisel aastal olnud müokardiinfarkt, ebastabiilne või eluohtlik südamearütmia, kes olid eelmisel aastal hospitaliseeritud südamepuudulikkuse tõttu, või paroksüsmaalse tahhükardia (>100 lööki/min) diagnoosiga. Seega on andmed nende patsiendirühmade kohta piiratud. Neil patsiendirühmadel tuleb Striverdi Respimat’i kasutada ettevaatusega.
Kardiovaskulaarsed toimed
Nagu teised
Hüpokaleemia
Mõnel patsiendil võivad
Hüperglükeemia
Anesteesia
Plaanilisel operatsioonil halogeniseeritud süsivesinikanesteetikumidega tuleb olla ettevaatlik, kuna suureneb tundlikkus
Striverdi Respimat’i ei tohi kasutada koos ühegi teise pikatoimelisi
Patsiente, kes on regulaarselt (nt neli korda ööpäevas) kasutanud inhaleeritavaid lühitoimelisi beeta- adrenergiliste retseptorite agoniste, tuleb õpetada neid kasutama ainult ägedate respiratoorsete sümpomite leevendamiseks.
4.5Koostoimed teiste ravimitega ja muud koostoimed
Adrenergilised ravimid
Samaaegne teiste adrenergiliste ravimite manustamine (üksikult või kombineeritud ravi osana) võib võimendada Striverdi Respimat’i kõrvaltoimeid.
Ksantiini derivaadid, steroidid või diureetikumid
Samaaegne ravi ksantiini derivaatide, steroidide või kaaliumi mittesäästvate diureetikumidega võib võimendada adrenergiliste retseptorite agonistide igasuguseid hüpokaleemilisi toimeid (vt lõik 4.4).
Beetablokaatorid
MAO inhibiitorid ja tritsüklilised antidepressandid, QTc intervalli pikendavad ravimid
Monoamiini oksüdaasi inhibiitorid, tritsüklilised antidepressandid ja teised teadaolevalt QTc intervalli pikendavad ravimid võivad tugevdada Striverdi Respimat’i toimet kardiovaskulaarsüsteemile.
Farmakokineetilised ravimkoostoimed
Ravimi koostoime uuringutes, milles samaaegselt manustati flukonasooli kui CYP2C9 inhibiitorit, ei täheldatud olulist toimet olodaterooli plasmakontsentratsioonile.
Ketokonasooli kui tugeva
Olodaterooli ja tiotroopiumi samaaegne manustamine ei avaldanud olulist toimet kummagi ravimi plasmakontsentratsioonile.
In vitro uuringud on näidanud, et olodaterool ei inhibeeri kliinilises praktikas saavutatavate plasmakontsentratsioonide korral CYP ensüüme ega transportvalke.
4.6Fertiilsus, rasedus ja imetamine
Rasedus
Striverdi Respimat’i kasutamise kohta rasedatel andmed puuduvad.
Loomkatsed ei näita otsest ega kaudset kahjulikku toimet reproduktiivsusele kliiniliselt oluliste kontsentratsioonide korral (vt lõik 5.3).
Ettevaatusmeetmena on eelistatav Striverdi Respimat’i kasutamist raseduse ajal vältida.
Nagu teised
Imetamine
Olodaterooli kasutavate imetavate naiste kohta kliinilised andmed puuduvad. Ei ole teada, kas olodaterool/metaboliidid erituvad inimese rinnapiima. Olemasolevad farmakokineetilised/toksikoloogilised andmed loomadel on näidanud olodaterooli ja/või tema metaboliitide eritumist emapiima.
Kuna inimese ööpäevase annuse 5 µg puhul on olodaterooli/metaboliitide plasmakontsentratsioon imetaval naisel tühine, ei ole olulisi toimeid rinnapiima saaval vastsündinul/imikul oodata.
Rinnaga toitmise katkestamine või ravi katkestamine/jätkamine Striverdi Respimat’iga tuleb otsustada, arvestades imetamise kasu lapsele ja ravi kasu naisele.
Fertiilsus
Striverdi Respimat’i kasutamise kohta seoses fertiilsusega kliinilised andmed puuduvad. Olodaterooliga läbiviidud prekliinilised uuringud ei näidanud soovimatuid toimeid fertiilsusele.
4.7Toime reaktsioonikiirusele
Ravimi toime kohta autojuhtimise ja masinate käsitsemise võimele ei ole uuringuid läbi viidud.
Siiski tuleb patsiente hoiatada, et kliinilistes uuringutes on täheldatud pearinglust. Seega tuleb soovitada ettevaatust autojuhtimisel või masinate käsitsemisel. Kui patsientidel esineb pearinglus, peavad nad vältima potentsiaalselt ohtlikke tegevusi, nagu autojuhtimine või masinate käsitsemine.
4.8Kõrvaltoimed
a.Ohutusprofiili kokkuvõte
Kõige sagedasemad kõrvaltoimed soovitatava annuse puhul olid nasofarüngiit, pearinglus, hüpertensioon, lööve ja liigesevalu. Need olid intensiivsuselt tavaliselt kerged või mõõdukad.
b.Kõrvaltoimete kokkuvõte tabelina
Allpool loetletud kõrvaltoimete kinnitatud esinemissagedused põhinevad esialgsetel kõrvaltoimete esinemissageduse määradel (st olodateroolile omistatud juhtudel), mida täheldati 5 mikrogrammi olodaterooli rühmas (1035 patsienti), mis oli kogutud kuuest platseebokontrolliga paralleelrühmadega kliinilisest uuringust KOK patsientidega, kelle raviperioodid olid vahemikus 4...48 nädalat. Esinemissagedus on defineeritud järgneva tava kohaselt:
Väga sage (≥1/10); sage (≥1/100 kuni <1/10);
Organsüsteemi klass / MedDRA meelistermin |
Esinemissagedus |
Infektsioonid ja infestatsioonid |
|
Nasofarüngiit |
|
|
|
Närvisüsteemi häired |
|
Pearinglus |
|
|
|
Vaskulaarsed häired |
|
Hüpertensioon |
Harv |
|
|
Naha ja nahaaluskoe kahjustused |
|
Lööve |
|
|
|
|
|
Liigesevalu |
Harv |
c.Valikuliste kõrvaltoimete kirjeldus
Lööbe esinemist võib pidada ülitundlikkusreaktsiooniks Striverdi Respimat’i suhtes. Nii nagu kõigi paikselt imenduvate ravimite puhul, võivad areneda muud ülitundlikkusreaktsioonid.
d.
Striverdi Respimat kuulub pikatoimeliste
Võimalikest kõrvaltoimetest teavitamine
Ravimi võimalikest kõrvaltoimetest on oluline teavitada ka pärast ravimi müügiloa väljastamist. See võimaldab jätkuvalt hinnata ravimi kasu/riski suhet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest kõrvaltoimetest www.ravimiamet.ee kaudu.
4.9Üleannustamine
Sümptomid
Olodaterooli üledoos põhjustab tõenäoliselt
Üleannustamise ravi
Ravi Striverdi Respimat’iga tuleb lõpetada. Näidustatud on toetav ja sümptomaatiline ravi. Tõsistel juhtudel tuleb patsiendid hospitaliseerida. Võib kaalutleda kardioselektiivsete beetablokaatorite kasutamist, kuid ainult äärmise ettevaatusega, kuna
5.FARMAKOLOOGILISED OMADUSED
5.1Farmakodünaamilised omadused
Farmakoterapeutiline rühm: Hingamisteede obstruktiivsete haiguste raviks kasutatavad ained; Selektiivsed
Toimemehhanism
Olodaterool omab kõrget afiinsust ja selektiivsust inimese
In vitro uuringud on näidanud, et olodaterool omab
Farmakoloogiline toime avaldub
Nende retseptorite aktiveerumisega hingamisteedes kaasneb tsüklilise
Olodateroolil on pikatoimelise selektiivse
Toimed südame elektrofüsioloogiale
Topeltpimedas, randomiseeritud, platseebo- ja võrdlusravimi (moksifloksatsiin) kontrolliga uuringus
Kliiniline efektiivsus ja ohutus
Striverdi Respimat’i 3. faasi kliiniline arendusprogramm hõlmas nelja paari randomiseeritud, topeltpimedaid, platseebokontrolliga korduvuuringuid 3533 KOK patsiendiga (1281 said 5- mikrogrammilisi annuseid, 1284 said
(i)kaks platseebo- ja aktiivse kontrolliga, paralleelgruppidega,
(ii)kaks platseebokontrolliga, paralleelgruppidega,
(iii)kaks platseebo- ja aktiivse kontrolliga,
(iv)kaks platseebo- ja aktiivse kontrolliga,
Kõik uuringud sisaldasid kopsufunktsiooni mõõtmisi (forsseeritud ekspiratsioonimaht sekundis, FEV);
3. faasi programmi värvatud patsiendid olid vähemalt
Patsientide üldiseloomustus
Ülemaailmsetesse
Kopsufunktsioon
säilis 24 tunni jooksul (FEV1
Düspnoe, tervisega seotud elukvaliteet, erakorraliste ravimite kasutamine, patsientide globaalne hinnang
Platseebo- ja aktiivse kontrolliga,
24 nädala pärast ei täheldatud olulist TDI keskse skoori erinevust Striverdi Respimat’i, formoterooli ja platseebo vahel, mis oli tingitud ootamatust paranemisest platseeborühmas ühes uuringus (tabel 1). Post hoc analüüsis kanti see patsientide ravi lõpetamiste arvele; Striverdi Respimat’i ja platseebo vahel esines oluline erinevus.
Tabel 1 |
TDI keskne skoor pärast 24 ravinädalat |
|
|
|
|
|
|
|
|
Ravi keskmine |
Erinevus platseebost |
|
|
|
Keskmine |
Primaarne |
Platseebo |
1,5 (0,2) |
|
analüüs |
|
|
|
|
Olodaterool 5 µg üks kord |
1,9 (0,2) |
0,3 (p=0,1704) |
|
ööpäevas |
|
|
|
Formoterool 12 µg kaks korda |
1,8 (0,2) |
0,2 (p=0,3718) |
|
ööpäevas |
|
|
Platseebo |
1,5 (0,2) |
|
|
analüüs |
|
|
|
|
Olodaterool 5 µg üks kord |
2,0 (0,2) |
0,5 (p=0,0270) |
|
ööpäevas |
|
|
|
Formoterool 12 µg kaks korda |
1,8 (0,2) |
0,4 (p=0,1166) |
|
ööpäevas |
|
|
24 nädala pärast oli Striverdi Respimat oluliselt parandanud keskmist SGRQ üldskoori, võrreldes platseeboga (tabel 2). Paranemised olid näha kõigis kolmes SGRQ valdkonnas (sümptomid, tegevused, mõju). SGRQ üldskoori paranemine üle MCID (minimaalne kliiniliselt oluline erinevus) (4
ühikut) esines rohkem Striverdi Respimat’i kui platseebo patsientidel (vastavalt 50,2% ja 36,4%, p<0,0001).
Tabel 2 |
SGRQ üldskoorid pärast 24 ravinädalat |
|
|
|
|
|
|
|
|
Ravi keskmine |
Erinevus platseebost |
|
|
(muutus |
Keskmine |
|
|
algväärtusest) |
|
Üldskoor |
Algväärtus |
44,4 |
|
|
Platseebo |
41,6 |
|
|
Olodaterool 5 µg üks kord ööpäevas |
38,8 |
|
|
Formoterool 12 µg kaks korda |
40,4 |
|
|
ööpäevas |
|
|
Striverdi Respimat’iga ravitud patsiendid kasutasid vähem päevast ja öist erakorralist salbutamooli kui platseebo patsiendid.
Igas
Lapsed
Euroopa Ravimiamet ei kohusta esitama Sriverdi Respimatiga läbi viidud uuringute tulemusi laste kõikide alarühmade kohta kroonilise obstruktiivse kopsuhaiguse (KOK) korral (teave lastel kasutamise kohta: vt lõik 4.2).
5.2Farmakokineetilised omadused
a.Üldtutvustus
Teave olodaterooli farmakokineetika kohta on saadud tervetelt inimestelt ning KOK ja astma patsientidelt pärast terapeutiliste ja suuremate annuste suukaudset inhaleerimist.
Pärast ühekordseid inhalatsiooniannuseid 5...70 mikrogrammi ja korduvaid inhalatsiooniannuseid 2...20 mikrogrammi üks kord ööpäevas täheldati olodateroolil lineaarset farmakokineetikat ja plasmakontsentratsiooni
Olodaterooli korduval inhaleerimisel üks kord ööpäevas saabus tasakaalukontsentratsioon 8 päeva pärast ja ringleva aine kogus suurenes kuni 1,8 korda, võrreldes ühekordse annustamisega.
b.Toimeaine üldiseloomustus pärast ravimi manustamist
Imendumine
Olodaterooli maksimaalne kontsentratsioon plasmas saabub tavaliselt 10...20 minuti jooksul pärast ravimi inhaleerimist. Tervetel vabatahtlikel oli olodaterooli absoluutne biosaadavus pärast inhalatsiooni hinnanguliselt ligikaudu 30%, kusjuures pärast suukaudse lahuse manustamist oli see alla 1%. Seega määrab olodaterooli süsteemse kättesaadavuse pärast inhalatsiooni peamiselt imendumine kopsudest.
Jaotumine
Olodateroolil esineb nii pärast inhalatsiooni kui veenisisest manustamist mitmekambriline paigutuskineetika. Jaotusruumala on suur (1110 l), mis viitab ulatuslikule jaotumisele kudedes. [C] olodaterooli seonduvus inimese plasmavalkudega in vitro ei olene kontsentratsioonist ja on ligikaudu 60%.
Olodaterool on
Biotransformatsioon
Olodaterool metaboliseerub olulisel määral otsese glükuroniseerumise ja metüülrühma O- demetüleerumise kaudu, millele järgneb konjugeerumine. Kuuest tuvastatud metaboliidist seondub
Olodaterooli
Eritumine
Tervetel vabatahtlikel on olodaterooli totaalne kliirens 872 ml/min ja renaalne kliirens 173 ml/min.
Pärast
Pärast inhalatsiooni langeb olodaterooli kontsentratsioon plasmas mitmefaasiliselt lõpliku poolväärtusajaga ligikaudu 45 tundi.
c.Patsientide iseloomustus
Teostati farmakokineetiline
Analüüs näitas, et arvestades KOK patsientide vanuse, soo ja kehakaalu mõju plasmakontsentratsioonile pärast Striverdi Respimat’i inhalatsiooni, ei ole vaja annust korrigeerida.
Neerupuudulikkus
Neerukahjustusega patsientidel ei esinenud kliiniliselt olulist plasmakontsentratsiooni suurenemist.
Maksapuudulikkus
Kerge või mõõduka maksakahjustusega patsientide ja tervete kontrollisikute vahel ei esinenud erinevust olodaterooli eliminatsioonis ega valguseonduvuses. Raske maksakahjustusega patsientidel ei ole uuringuid teostatud.
Rass
Farmakokineetiliste andmete võrdlus uuringusiseselt ja uuringute lõikes näitas, et jaapanlastel ja teistel Aasia päritolu patsientidel kaldus plasmakontsentratsioon olema kõrgem kui europiidsel populatsioonil.
Europiidse ja aasia populatsiooniga läbiviidud kuni
5.3Prekliinilised ohutusandmed
Mittekliinilistes uuringutes täheldati toimeid vaid soovitatud kliinilistest maksimaalsetest annustest tunduvalt suuremate annuste manustamisel, mis on kliinilises kasutuses väheoluline.
Genotoksilisuse ja kartsinogeense potentsiaali mittekliinilised uuringud ei ole näidanud kahjulikku toimet inimesele.
Rottidel täheldati mesovariumi leiomüoomi ja hiirtel emaka leiomüoomi ja leiomüosarkoomi esinemissageduse tõusu. Seda peetakse ravimiklassi toimeks, mida täheldatakse närilistel pärast
Rottidel ei esinenud pärast annuste kuni 1054 mikrogrammi/kg/ööpäevas inhaleerimist teratogeenset toimet (ligikaudu
Olulisi toimeid ei esinenud inhalatsiooniannuse 974 mikrogrammi/kg/ööpäevas (ligikaudu 1580- kordne MRHDID täiskasvanutel mg/m2 baasil) puhul.
6.FARMATSEUTILISED ANDMED
6.1Abiainete loetelu
Bensalkooniumkloriid
Dinaatriumedetaat
Puhastatud vesi
Sidrunhape (veevaba)
6.2Sobimatus
Ei kohaldata.
6.3Kõlblikkusaeg
3 aastat
Kõlblikkusaeg pärast esimest kasutamist: 3 kuud
6.4Säilitamise eritingimused
Mitte lasta külmuda.
6.5Pakendi iseloomustus ja sisu
Ravimi sisepakendi tüüp ja materjal:
Lahus paikneb polüetüleenist/polüpropüleenist kolbampullis, millel on polüpropüleenkaas koos sellega ühendatud silikoonrõngaga. Kolbampull on suletud alumiiniumsilindriga.
Üks kolbampull sisaldab 4 ml inhalatsioonilahust.
Pakendi suurused ja kaasasolevad seadmed:
Üksikpakend: 1 Respimat inhalaator ja 1 kolbampull, milles sisaldub 60 pihustusannust (30 raviannust).
Kõik pakendi suurused ei pruugi olla müügil.
6.6Erihoiatused ravimpreparaadi hävitamiseks ja käsitlemiseks
Kasutamata ravimpreparaat või jäätmematerjal tuleb hävitada vastavalt kohalikele nõuetele.
7.MÜÜGILOA HOIDJA
Boehringer Ingelheim International GmbH
Binger Strasse 173
Saksamaa
8.MÜÜGILOA NUMBER
9.ESMASE MÜÜGILOA VÄLJASTAMISE/MÜÜGILOA UUENDAMISE KUUPÄEV
Müügiloa esmase väljastamise kuupäev: 03.10.2013
10.TEKSTI LÄBIVAATAMISE KUUPÄEV
mai 2016
